Bài 16. Hòa tan hoàn toàn 12,8 gam đồng bằng dung dịch H2SO4 đặc, nóng, dư thu được dung dịch X và V lít khí SO2 (đktc).Phương trình hóa học như sau: Cu + H2SO4 đặc,nóng CuSO4 + SO2 + H2Oa.Lập PTHH theo phương pháp thăng bằng electron, chỉ rõ chất khử, chất oxi hóa, QT oxi hóa, QT khử. b.Tính V.Bài 17: Hòa tan hoàn toàn 11,2 gam sắt bằng dung dịch H2SO4 đặc, nóng, dư thu được dung dịch X và V lít khí SO2 (đktc). Phương trình phản...
Đọc tiếp
Bài 16. Hòa tan hoàn toàn 12,8 gam đồng bằng dung dịch H2SO4 đặc, nóng, dư thu được dung dịch X và V lít khí SO2 (đktc).Phương trình hóa học như sau: Cu + H2SO4 đặc,nóng CuSO4 + SO2 + H2O
a.Lập PTHH theo phương pháp thăng bằng electron, chỉ rõ chất khử, chất oxi hóa, QT oxi hóa, QT khử. b.Tính V.
Bài 17: Hòa tan hoàn toàn 11,2 gam sắt bằng dung dịch H2SO4 đặc, nóng, dư thu được dung dịch X và V lít khí SO2 (đktc). Phương trình phản ứng như sau: Fe + H2SO4 đặc,nóng Fe2(SO4)3 + SO2 + H2O a.Lập PTHH theo phương pháp thăng bằng electron, chỉ rõ chất khử, chất oxi hóa, QT oxi hóa, QT khử. b.Tính V
. Bài 18: Hoà tan hoàn toàn 8,8 gam hỗn hợp A gồm Cu và Fe trong 100ml dd H2SO4 x (mol/lít) theo các phản ứng sau: Fe + H2SO4 đặc,nóng Fe2(SO4)3 + SO2 + H2O (1) Cu + H2SO4 đặc,nóng CuSO4 + SO2 + H2O (2) Sau khi các phản ứng kết thúc thu được dung dịch B và 4,48 lít khí SO2 (đktc). a.Lập các phương trình hóa học (1) và (2). b.Tính % khối lượng mỗi chất có trong A. c.Để tác dụng vừa hết với các chất có trong dung dịch B cần 200ml dung dịch NaOH 4M. Tính giá trị của x
. Bài 19: Hoà tan hết 17 gam hỗn hợp bột A gồm Al và FeCO3 trong 300ml dung dịch HCl 2M thu được dung dịch B và 5,6 lít hỗn hợp khí C (đktc). a) Tính % khối lượng mỗi chất có trong A. b) Tính thể tích dung dịch NaOH 0,5M cần để trung hoà hết lượng axit có trong dung dịch B
. Bài 20: Hoà tan hết 13 gam hỗn hợp bột A gồm Mg và Na2CO3 trong Vml dung dịch H2SO4 1M (loãng) thu được 4,48 lít hỗn hợp khí B (đktc) và dung dịch C. a) Tính % khối lượng mỗi chất có trong A. b) Cho dung dịch C tác dụng với dung dịch Ba(OH)2 dư, lọc kết tủa nung đến khối lượng không đổi được 62,25 gam chất rắn. Tính V.



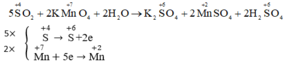

Cu+2H2SO4→CuSO4+SO2+2H2OCu+2H2SO4→CuSO4+SO2+2H2O
Cu+0→Cu+2+2e ××1
S+6+2e→S+4 ××1
Trả lời:
\(Cu+2H_2SO_4\rightarrow CuSO_4+2H_2O+SO_2\uparrow\)
~HT~