Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

chứa % tạp chất vậy đó là bao nhiêu phần trăm em ơi?

2Al2O3\(\rightarrow\) 4Al + 3O2
mAl2O3= \(\frac{1000.20}{100}\)=200(kg)
Theo PTHH: mAl= 400(kg)
Vì có chứa 1,5% tạp chất
\(\rightarrow\)mAl thu được là trên lí thuyết là \(\frac{\text{400 - 400.1,5}}{100}\)=394(kg)
vì H=95% \(\Rightarrow\) mAl thực tế thu được là \(\frac{\text{394.95}}{100}\)=374,3(kg)

Nửa tấn=500000g
2Al2O3-->4Al+3O2
Khối lượng Al2O3 nguyên chất trong nửa tấn quặng bô-xít là
500000.50%=250000(g)
Số mol của Al2O3 là
n=m/M=250000/102
=125000/51(mol)
Số mol của Al là
nAl=2nAl2O3=2.125000/51
=250000/51(mol)
Khối lượng của Al là
m=n.M=250000/51.27
=2250000/17( g)
Khối lượng của Al nguyên chất là
2250000/17-
(2250000/17.1.5%)
=2216250/17(g)

Đặt mA = a (tấn); mB = b (tấn)
Giả sử a + b = 1 (tấn) (1)
\(m_{Fe_2O_3\left(A\right)}=a.60\%=0,6a\left(tấn\right)=6.10^5a\left(g\right)\)
=> \(n_{Fe_2O_3\left(A\right)}=\dfrac{6.10^5a}{160}=3750a\left(mol\right)\Rightarrow n_{Fe\left(A\right)}=7500a\left(mol\right)\)
\(m_{Fe_3O_4\left(B\right)}=b.69,6\%=0,696b\left(tấn\right)=696.10^3b\left(g\right)\)
=> \(n_{Fe_3O_4\left(B\right)}=\dfrac{696.10^3b}{232}=3000b\left(mol\right)\Rightarrow n_{Fe\left(B\right)}=9000b\left(mol\right)\)
\(n_{Fe\left(tổng\right)}=\dfrac{0,48.10^6}{56}=\dfrac{60000}{7}\left(mol\right)\)
=> \(7500a+9000b=\dfrac{60000}{7}\) (2)
(1)(2) => \(a=\dfrac{2}{7}\left(tấn\right);b=\dfrac{5}{7}\left(tấn\right)\)
=> \(\dfrac{a}{b}=\dfrac{2}{5}\)

Đặt mA = a (tấn); mB = b (tấn)
Giả sử a + b = 1 (tấn) (1)
\(m_{Fe_2O_3\left(A\right)}=a.60\%=0,6a\left(tấn\right)=6.10^5a\left(g\right)\)
=> \(n_{Fe_2O_3\left(A\right)}=\dfrac{6.10^5a}{160}=3750a\left(mol\right)\Rightarrow n_{Fe\left(A\right)}=7500a\left(mol\right)\)
\(m_{Fe_3O_4\left(B\right)}=b.69,6\%=0,696b\left(tấn\right)=696.10^3b\left(g\right)\)
=> \(n_{Fe_3O_4\left(B\right)}=\dfrac{696.10^3b}{232}=3000b\left(mol\right)\Rightarrow n_{Fe\left(B\right)}=9000b\left(mol\right)\)
\(n_{Fe\left(tổng\right)}=\dfrac{0,48.10^6}{56}=\dfrac{60000}{7}\left(mol\right)\)
=> \(7500a+9000b=\dfrac{60000}{7}\) (2)
(1)(2) => \(a=\dfrac{2}{7}\left(tấn\right);b=\dfrac{5}{7}\left(tấn\right)\)
=> \(\dfrac{a}{b}=\dfrac{2}{5}\)

\(n_{Al}=\frac{108\cdot1000}{27}=4000\left(mol\right)\)
PTHH : \(2Al_2O_3\underrightarrow{dpnc\left(criolit\right)}4Al+3O_2\)
Theo PTHH : \(n_{Al_2O_3}=\frac{1}{2}n_{Al}=2000\left(mol\right)\)
=> \(m_{Al_2O_3}=2000.102=204000\left(g\right)=204\left(kg\right)\)
Mà hiệu suất phản ứng là 80% => \(m_{Al_2O_3\left(thực\right)}=\frac{204}{80}\cdot100=255\left(kg\right)\)
=> \(m_{quặng}=\frac{255}{50}\cdot100=510\left(kg\right)\)

a/ nAl= 54/27= 2(mol)
nO2=48/32=1,5(mol)
PTHH: 2 Al2O3 -to-> 4 Al +3 O2
Ta có: 2/4 = 1,5/3
=> P.ứ hết
=> nAl2O3= 1/2. nAl=1/2. 2=1(mol)
=> mAl2O3=1.102=102(g)
b) %mAl2O3= (102/127,5).100= 80%
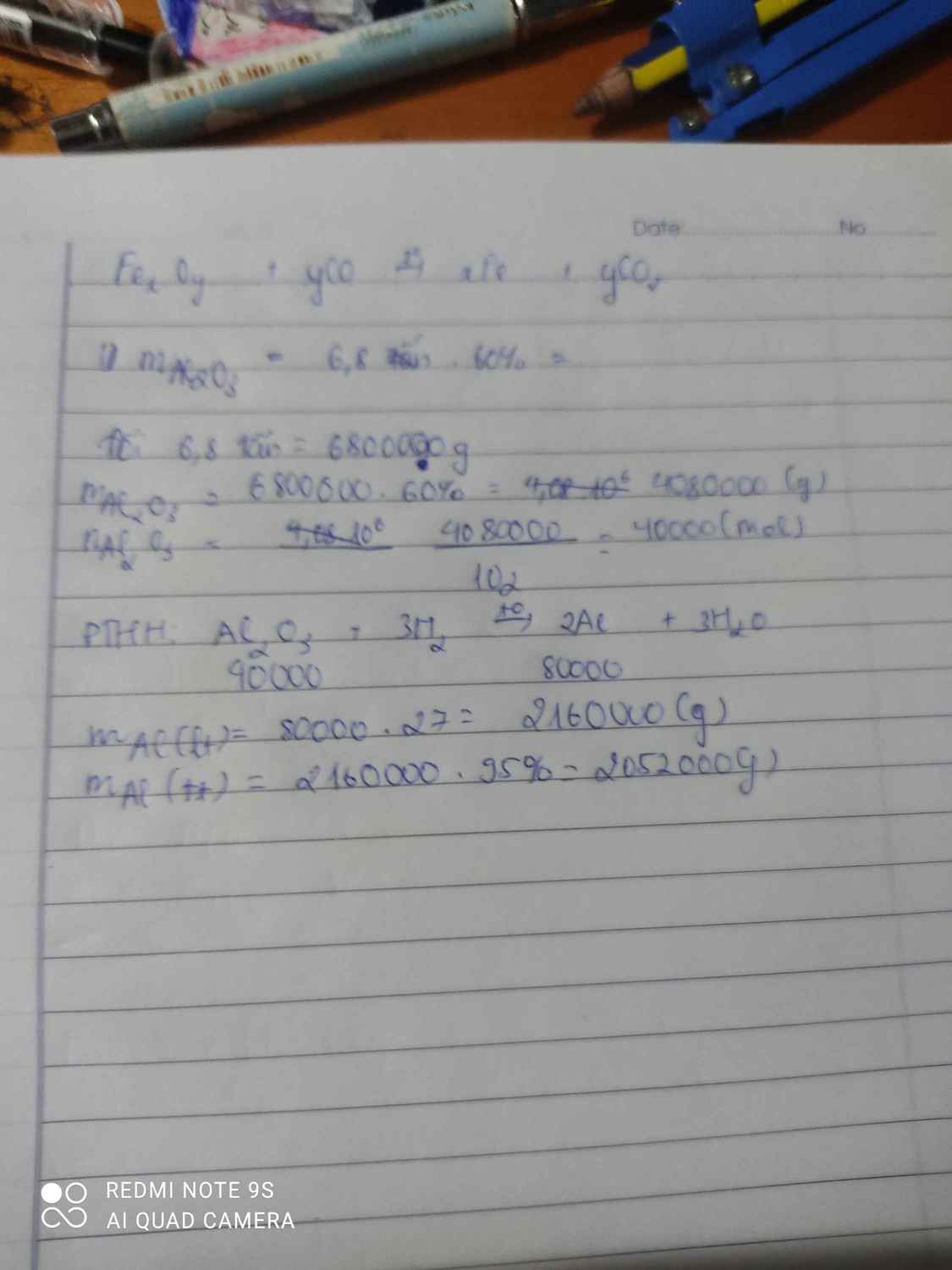
Đổi 1 tấn boxit = 1000kg
+mAl2O3 = 1000*81,6%= 816kg = 816000g
Để sản xuất Al người ta cần khử O2 từ Al2O3 bằng H2
-> nAl2O3 = 816000/102=8000mol
PT : Al2O3 + 3H2 --t-> 2Al + 3H2O
theo PT : nAl = 2nAl2O3 = 16000 mol
-> mAl thu được = 16000 * 27 = 432000g = 432 tấn