Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

n H2O = 1,08 / 18 = 0,06 (mol)
=> nH = 0,06 x 2 = 0,12 (mol)
=> mH = 0,12 x 1 = 0,12 (g)
n SO2 = 1,344 / 22,4 = 0,06 (mol)
=> n S = 0,06 (mol)
=> m S = 0,06 x 32 = 1,92 (g)
Vì: mO = mhh - mS - mH = 2,04 - 1,92 - 0,12 = 0 => Không có Oxi
Gọi HxSy là chất cần tìm
nH : nS = 0,12 : 0,06 = 2 : 1
=> Công thức đơn giản là (H2S)n
(H2S)n + 3n/2O2 --> nH2O + nSO2
____ __ _ __ _ _ _ _ 0,06 ----> 0,06n
lấy số mol nước đẩy qua số mol SO2 thì thấy 0,06n = 0,06 => n = 1
n H2S = 0,06 (mol)
Vậy đó là công thức H2S
2AgNO3 + H2S --> Ag2S + 2HNO3
0,06 ----> 0,06
=> m Ag2S = 0,06 x 248 = 14,88 g

Phương trình hóa học của phản ứng:
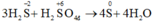
Do H2S có tính khử và H2SO4 có tính oxi hóa nên chúng có khả năng tác dụng với nhau sinh ra kết tủa vàng là S
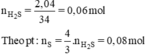
mS = 0,08 × 32 = 2,56g.

Xác định công thức phân tử của hợp chất A
nSO2 = 1,344 / 22,4 = 0,06 mol → mS = 0,06 x 32 = 1,92g
nH2O = 1,08 / 18 = 0,06 mol → mH = 0,06 x 2 = 0,12g.
Như vậy hợp chất A chỉ có nguyên tố S và H.
Đặt công thức phân tử hợp chất là HxSy.
Ta có tỉ lệ: x : y = 0,06 : 0,12 = 1: 2.
Vậy công thức phân tử của A và là H2S.
Phương trình hóa học của phản ứng:
nH2S = 2,04 / 34 = 0,06 mol.
3H2S + H2O → 4S + 4H2O.
nS = 4/3 nH2S = 0,08 mol.
mS = 0,08 × 32 = 2,56g.
Xác định công thức phân tử của hợp chất A
nSO2 = 1,344 / 22,4 = 0,06 mol → mS = 0,06 x 32 = 1,92g
nH2O = 1,08 / 18 = 0,06 mol → mH = 0,06 x 2 = 0,12g.
Như vậy hợp chất A chỉ có nguyên tố S và H.
Đặt công thức phân tử hợp chất là HxSy.
Ta có tỉ lệ: x : y = 0,06 : 0,12 = 1: 2.
Vậy công thức phân tử của A và là H2S.
Phương trình hóa học của phản ứng:
nH2S = 2,04 / 34 = 0,06 mol.
3H2S + H2O \(\rightarrow\) 4S + 4H2O.
nS = 4/3 nH2S = 0,08 mol.
mS = 0,08 × 32 = 2,56g.

Công thức phân tử của hợp chất A :
Số mol các sản phẩm của phản ứng :
n SO 2 = 0,1 mol; n H 2 O = 0,1 mol
Khối lượng của hiđro có trong 0,1 mol H 2 O (2 g.0,1 = 0,2 g) và khối lượng của lưu huỳnh có trong 0,1 mol SO 2 (32 g.0,1 = 3,2 g) đúng bằng khối lượng của hợp chất A đem đốt (3,4 g).
Vậy thành phần của hợp chất A chỉ có 2 nguyên tố là H và S.
- Tỉ lệ giữa số mol nguyên tử H và số mol nguyên tử S là :
n H : n S = 0,1.2 : 0,1 = 2 : 1
Công thức phân tử của hợp chất A là : H 2 S

a)Phương trình:
Zn+S→ZnS; Fe+S→FeS
ZnS+H2SO4→ZnSO4+H2S
FeS+H2SO4→FeSO4+H2S
b)Gọi m, m' là khối lượng Zn, Fe trong hỗn hợp ban đầu
m+m' = 3,72
nH2S=nZnS+nFeS=nZn+nFe=m/65+m'/56
=1,344/22,4=0,06
Bấm máy giải hệ phương trình:
m+m' = 3,72
(1/65).m+(1/56).m' = 0,06
ta được nghiệm: m = 2,6 ; m' = 1,12VV

Xác định công thức phân tử của hợp chất A
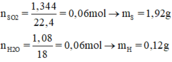
Như vậy hợp chất A chỉ có nguyên tố S và H (Do mS + mH = 1,92 + 0,12 = 2,04 =mA)
Đặt công thức phân tử hợp chất là HxSy
Ta có tỉ lệ x : y = nH : nS = 0,12 : 0,06 = 2 : 1
Vậy công thức phân tử của A và là H2S.

Nồng độ phần trăm của các chất trong dung dịch :
Biết số mol NaOH (0,3 mol) nhiều hơn 2 lần số mol SO 2 (0,1 mol) vậy sản phẩm là muối Na 2 SO 3 . Ta có PTHH :
SO 2 + 2NaOH → Na 2 SO 3 + H 2 O
- Khối lượng của dung dịch sau phản ứng :
m dd = 146,6 + 3,4 = 150 (g)
- Khối lượng các chất có trong dung dịch sau phản ứng :
m Na 2 SO 3 = 126.0,1 = 12,6g
m NaOH dư = 40.(0,3 - 0,2) = 4g
- Nồng độ phần trăm các chất trong dung dịch sau phản ứng :
C % Na 2 SO 3 = 12,6/150 x 100% = 8,4%
C % NaOH dư = 4/150 x 100% = 2,67%

a.
Do E gồm hai oxit nên Mg, CuCl2 hết, Fe đã phản ứng
Phương trình
Mg + CuCl2 \(\rightarrow\) MgCl2 + Cu (1)
Fe + CuCl2 \(\rightarrow\) FeCl2 + Cu (2)
Khi cho NaOH dư vào
2NaOH + MgCl2 \(\rightarrow\) Mg(OH)2 + 2NaCl (3)
2NaOH + FeCl2 \(\rightarrow\) Fe(OH)2 + 2NaCl (4)
Khi nung
Mg(OH)2 \(\underrightarrow{t^o}\) MgO + H2O (5)
4Fe(OH)2 +O2 \(\underrightarrow{t^o}\) 4Fe2O3 + 4H2O (6)
b.
Đặt số mol của Fe, Mg có ban đầu lần lượt là x, y, số mol Fe dư là t (x, y>0, t\(\ge\)0)
Có hệ \(\begin{cases}24x+56y+0t=3,16\\40x+64y-8t=3,84\\40x+80y-80t=1,4\end{cases}\)\(\Rightarrow\)\(\begin{cases}x=0,015mol\\y=0,05mol\\t=0,04mol\end{cases}\)
Vậy trong hỗn hợp đầu %mMg = \(\frac{0,015.24}{3,16}.100\)=11,392%
%mFe=100%-11,392% = 88,608%
Nồng độ của CuCl2: z =0,025:0,25=0,1M


- B