Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giải thích:
Gọi số mol của Na và Al lần lượt là x và 2x (mol)
Na + H2O → NaOH + 0,5H2
x x 0,5x
Al + NaOH + H2O → NaAlO2 + 1,5H2
x ← x → x → 1,5x
nH2 = 0,4 => 0,5x + 1,5x = 0,4 => x = 0,2
Chất rắn không tan là Al dư: nAl dư = 2x – x = x = 0,2 mol
=> m = mAl dư = 27.0,2 = 5,4 gam
Đáp án D

Chọn D
Gọi số mol Na là x mol → số mol Al là 2x mol. Theo bài ra chất rắn không tan sau phản ứng là Al dư.


Đáp án C
nH2 = 0,15 mol ; nAl(OH)3 = 0,5 mol
- Hỗn hợp rắn X gồm: Fe, Al2O3 (x mol) và Al dư (y mol)
PTHH:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
CO2 + Na[Al(OH)4] → Al(OH)3 + NaHCO3
nH2 = 0,15 mol → y = 0,1 mol
Áp dụng ĐLBT nguyên tố với Al: 2x + y = 0,5 → x = 0,2 mol
Áp dụng ĐLBT nguyên tố với O: nO(Fe3O4) = nO(Al2O3) = 0,2.3=0,6 mol
⇒ nFe3O4 = 0,15mol
Áp dụng nguyên tố với Fe: nFe = 3nF3O4 = 3.0,15 = 0,45 mol
Áp dụng khối lượng: m = 0,45.56 + 0,2.102 + 0,1.27 = 48,3 gam

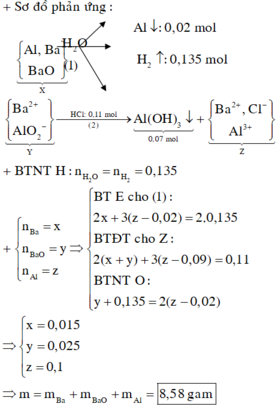
Gọi x = nNa
Na + H2O → NaOH + 1 2 H2
x → x → 0,5x
Al + NaOH + H2O → NaAlO2 + 3 2 H2
x ← x → 1,5x
Do sau phản ứng, thu được chất rắn Y nên Al vẫn còn dư ⇒ NaOH hết
Vậy ∑nH2 = 0,5x + 1,5x = 8 , 96 22 , 4 ⇒ x = 0,2
⇒ mNa + mAl pư = 23x + 27x = 10g ⇒ mAl còn dư = 16,75 – 10 = 6,75g ⇒ Chọn A