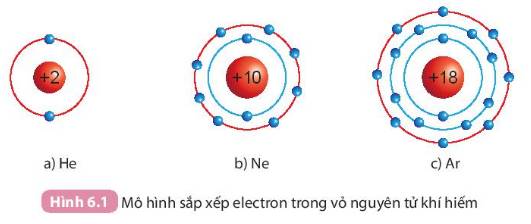
Quan sát Hình 6.1, so sánh số electron lớp ngoài cùng của He, Ne và Ar
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


He: 1 s 2 ; Ne: 2 s 2 2 p 6 ; Ar: 3 s 2 3 p 6
Kr: 4 s 2 4 p 6 ; Xe: 5 s 2 5 p 6 ; Rn: 6 s 2 6 p 6
Nguyên tử của các nguyên tố trong nhóm (trừ heli) đều có 8 electron ở lớp ngoài cùng với cấu hình ns 2 np 6 . Đó là cấu hình electron vững bền. He có cấu hình 1 s 2 , nhưng với cấu hình đó, lớp electron ngoài cùng đã bão hoà nên He cũng là một nguyên tử vững bền.
Các nguyên tố thuộc nhóm VIIIA được gọi là các khí hiếm. Các khí hiếm đều khó tham gia các phản ứng hoá học. Ở điều kiện thường, các nguyên tử không liên kết với nhau tạo thành phân tử. ở điều kiện thường, các khí hiếm đều ở trạng thái khí, phân tán.

Hóa trị của H và Cl đều là I, bằng với số electron mà nguyên tử H và Cl góp chung để tạo ra liên kết.

Ne : 1 s 2 2 s 2 2 p 6 ; Ar : 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6
Hai nguyên tử trên có 8 electron ở lớp ngoài cùng ns 2 np 6 là những nguyên tử có cấu hình electron bền vững, ít tham gia vào các phản ứng hoá học. Các nguyên tố này (kể cả heli) được gọi là các khí hiếm

- Nguyên tử Mg có 12 electron và 3 lớp electron
- Ion Mg2+ có 10 electron và 2 lớp electron
=> Nguyên tử Na đã mất đi 2 electron để tạo thành ion Mg2+

Ion Na+ ít hơn nguyên tử Na 1 eletron.
Ion Na+ ít hơn nguyên tử Na một lớp electron.
Hay nói cách khác nguyên tử Na cho đi 1 electron ở lớp ngoài cùng để trở thành ion mang điện tích dương, kí hiệu là Na+.

Nguyên tử Na có 1 electron ở lớp vỏ ngoài cùng (lớp 3). Ion Na+ có 8 electron ở lớp vỏ ngoài cùng (lớp 2)
Nguyên tử Cl có 7 electron ở lớp vỏ ngoài cùng (lớp 3). Ion Cl- có 8 electron ở lớp vỏ ngoài cùng (lớp 3)

a)He -> số e ngoài cùng: 2
b)Ne -> số e ngoài cùng: 8
c) Ar-> số e ngoài cùng: 8
Số electron lớp ngoài cùng của Ne = Ar = 8
Số electron lớp ngoài cùng của He = 2
=>He ít số electron lớp ngoài cùng hơn Ne và Ar
Số electron lớp ngoài cùng của các nguyên tố `He` nhỏ hơn số electron ngoài cùng của nguyên tố `Ar,Ne`
Số electron ngoài cùng của nguyên tố `Ar, Ne` bằng nhau `(` đều `=8e)`