Trộn 120ml dung dịch KOH 1m với 80ml dung dịch chứa hỗn hợp HNO3 0,5M và HCL 0,5M thu được dung dịch (A).Tính nồng độ mol của các chất trong dung dịch (A).( Giả thiết thể tích dung dịch thay đổi không đáng kể)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


[K+]=[Cl-]=0,25M
[KOH dư]=0,25M
b) 2KCl + H2SO4 ----------->K2SO4 + 2HCl
0,05(mol)---->0,025(mol)
=>vH2SO4=\(\frac{0,025}{1}\)=0,025(lít)
c)pH=-log(0,25)=0,602
(câu c mình không chắc chắn lắm nha bạn!!!)
Cho mình hỏi s [K+]=[Cl-]=0,25M đc z. Mình chưa hiểu lắm

30ml = 0,03l
70ml = 0,07l
\(n_{CaCl2}=0,5.0,03=0,015\left(mol\right)\)
\(n_{AgNO3}=1.0,07=0,07\left(mol\right)\)
Pt : \(CaCl_2+2AgNO_3\rightarrow Ca\left(NO_3\right)_2+2AgCl|\)
1 2 1 2
0,015 0,07 0,015 0,03
Lập tỉ số so sánh : \(\dfrac{0,015}{1}< \dfrac{0,07}{2}\)
⇒ CaCl2 phản ứng hết , AgNO3 dư
⇒ Tính toán dựa vào số mol của CaCl2
\(n_{AgCl}=\dfrac{0,015.2}{1}=0,03\left(mol\right)\)
⇒ \(m_{AgCl}=0,03.143,5=4,305\left(g\right)\)
\(n_{Ca\left(NO3\right)2}=\dfrac{0,03.1}{2}=0,015\left(mol\right)\)
\(n_{AgNO3\left(dư\right)}=0,07-\left(0,015.2\right)=0,04\left(mol\right)\)
Sau phản ứng :
\(V_{dd}=0,03+0,07=0,1\left(l\right)\)
\(C_{M_{Ca\left(NO3\right)2}}=\dfrac{0,015}{0,1}=0,15\left(M\right)\)
\(C_{M_{AgNO3\left(dư\right)}}=\dfrac{0,04}{0,1}=0,4\left(M\right)\)
Chúc bạn học tốt

B4:
nNaOH = 0,3 . 1,5 + 0,4 . 2,5 = 1,45 (mol)
VddNaOH = 0,3 + 0,4 = 0,7 (l)
CMddNaOH = 1,45/0,7 = 2,07M
B5:
nHCl (sau khi pha) = 0,5 . 2 = 1 (mol)
Gọi VHCl (0,2) = x (l); VHCl (0,8) = y (l)
x + y = 2 (1)
nHCl (0,2) = 0,2x (mol)
nHCl (0,8) = 0,8y (mol)
=> 0,2x + 0,8y = 1 (2)
(1)(2) => x = y = 1 (l)

a) Phương trình hóa học của phản ứng:
b) Theo pt (1): nCl2 = nMnCl2 = nMnO2 = 0,8 mol
Theo pt (2): nNaCl = nNaClO = nCl2 = 0,8 mol
nNaOH pư = 2. nCl2 = 2. 0,8 = 1,6 mol
⇒ nNaOH dư = 2 - 1,6 = 0,4 mol
Nồng độ mol/l của các chất trong dung dịch sau phản ứng:
CM (NaCl) = CM (NaClO) = CM(MnCl2) = 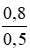
CM (NaOH)dư = 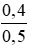
tích cho mình nha![]()

Đáp án B
nHNO3 = 0,72 mol ; nNaOH = 0,3 mol ; nKOH = 0,15 mol
Đặt nFe = x ; nCu = y => nFe2O3 = 0,5x ; nCuO = y
Ta có : 56x + 64y = 11,1g ; 80x + 80y = 15
=> x = 0,1125 ; y = 0,075
Giả sử chất rắn khan sau khi nung T gồm 0,3 mol NaNO2 và 0,15 mol KNO2
mT = 0,3.69 + 0,15.85 = 33,45g > 322,145g => trong chất rắn khan sau nung T có cả bazo dư
Đặt nNO2 = a ; nOH = b
0,3.23 + 0,15.39 + 46a + 17b = 32,145
a + b = 0,45
=> a = 0,405 ; b = 0,045
Do nNO3 muối = 0,405 < 3nFe + 2nCu = 3.0,1125 + 2.0,075 = 0,4875
=> Sản phẩm có cả Fe2+ và Fe3+ và HNO3 phản ứng hết.
Trong dung dịch X có : z mol Fe2+ ; t mol Fe3+ ; 0,075 mol Cu2+ ; 0,405 mol NO3-
Bảo toàn Fe : z + t = 0,1125
Bảo toàn điện tích : 2z + 3t + 2.0,075 = 0,405
=> z = 0,0825 và t = 0,03
Bảo toàn H : nH2O = ½ nHNO3 = 0,36 mol
Bảo toàn khối lượng : msp khử = mHNO3 – mNO3 muối – mNO3 (X) – mH2O = 13,77g
mdd X = mKL + mdd HNO3 – msp khử = 91,83g
=> C% Fe(NO3)3 = 7,91%


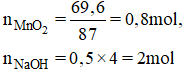
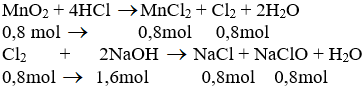


PTHH:
KOH + HNO3 -> KNO3 + H2O
KOH + HCl -> KCl + H2O
Ta có : nKOH = 1.0,12 = 0,12(mol)
=> nHNO3 = nHCl = 0,12(mol)
=> VHNO3 = 0,04(l)
=> VHCl=0,04(l)
Do thể tích không đổi nên Vsaupứ = 120+80 = 200(ml) = 0,2(l)
=> CMKNO3 = CMKCl = 0,04/0,2 = 0,2M