Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có: P = E (do nguyên tử trung hòa về điện.)
- Tổng số hạt trong M2X là 140.
⇒ 2.2PM + 2NM + 2PX + NX = 140 (1)
- Trong đó, số hạt mang điện là 92.
⇒ 2.2PM + 2PX = 92 (2)
- Số hạt mang điện trong M nhiều hơn X là 22.
⇒ 2PM - 2PX = 22 (3)
Từ (1), (2) và (3) \(\Rightarrow\left\{{}\begin{matrix}P_M=E_M=19\\P_X=E_X=8\end{matrix}\right.\)
Điện tích hạt nhân của M và X lần lượt là: +19 và +8

\(p_X+e_X+n_X=19\)
\(\rightarrow2p_X+n_X=19\left(1\right)\)
\(e_X-n_X=2\left(2\right)\)
Cộng 1 vào 2, ta có :
\(3p_X=21\)
\(p_X=7\)
Vậy nguyên tố là X là N ( nitơ )

Nguyên tử X có tổng cộng 19 hạt. Trong số này, có 2 hạt mang điện tích âm nhiều hơn số hạt không mang điện tích.

Ta có: p + e + n = 40
Mà p = e, nên: 2p + n = 40 (1)
Theo đề, ta có: n - p = 1 (2)
Từ (1) và (2), ta có HPT:
\(\left\{{}\begin{matrix}2p+n=40\\n-p=1\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}2p+n=40\\-p+n=1\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}3p=39\\n-p=1\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}p=13\\n=14\end{matrix}\right.\)
Vậy p = e = 13 hạt, n = 14 hạt.

Nguyên tử Y:
\(\left\{{}\begin{matrix}P+N+E=82\\P=E\\\left(P+E\right)-N=22\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}2P+E=82\\2P-N=22\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}P=E=Z=26\\N=30\end{matrix}\right.\)
Kí hiệu: \(^{56}_{26}Fe\)
* Nguyên tử X:
\(\left\{{}\begin{matrix}P+N+E=115\\P=E\\P+E=\dfrac{14}{9}N\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}2P+N=115\\2P-\dfrac{14}{9}N=0\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}P=E=Z=35\\N=45\end{matrix}\right.\)
Kí hiệu: \(^{80}_{35}Br\)
1/ Theo đề ta có:\(S=2Z+N=82\)(1)
\(2Z-N=22\)(2)
từ (1) và(2)\(\Rightarrow Z=26;N=30\)
A=Z+N=26+30=56
Vậy kí hiệu nguyên tử Y là\(^{56}_{26}Fe\)
2/Theo đề ta có:\(S=2Z+N=115\)(1)
\(2Z=\dfrac{14}{9}N\Leftrightarrow2Z-\dfrac{14}{9}N=0\)(2)
Từ (1) và (2)\(\Rightarrow Z=35;N=45\)
A=Z+N=35+45=80
Vậy kí hiệu nguyên tử X là \(^{80}_{35}Br\)
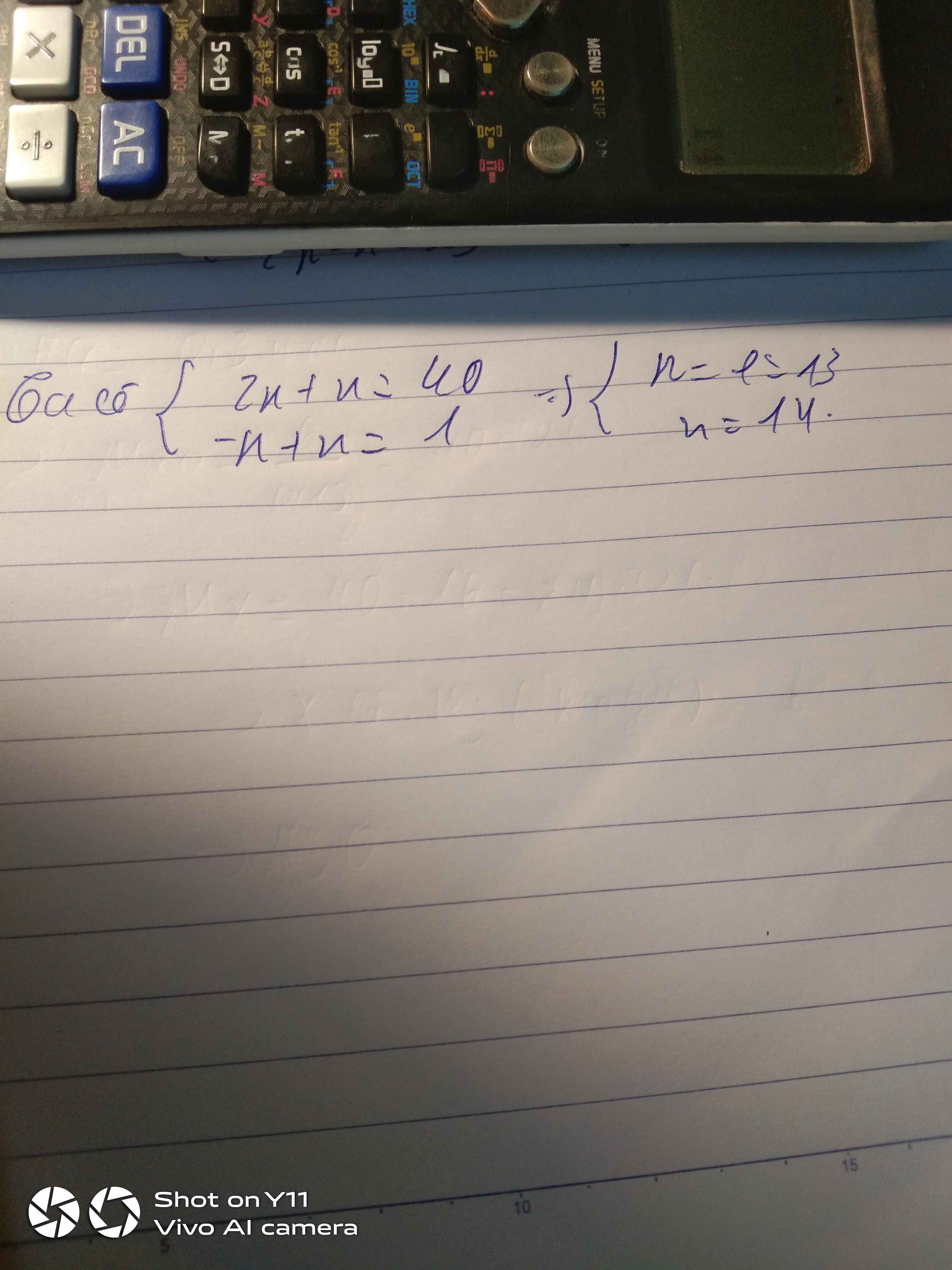
P2O5
a,cau nay hoi vuot tam cua mink