Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Trung hòa H+ và làm kết tủa các ion kim loại=> làm giảm độ chua của đất

Quặng đôlomit có thành phần MgCO3 .CaCO3
CaCO3.MgCO3 \(\rightarrow\) CaO + MgO + 2CO2 ↑
0,2_________________________0,4
Thành phần phần trăm về khối lượng của CaCO .MgCO trong loại quặng là :
%CaCO3.MgCO3 =\(\frac{0,2.\left(100+84\right)}{40}.100\%=92\%\)
MgCO3.CACO3=>CO2
nCo2=0.4=>nCACO3.MgCO3=0.2=>m=36.8g=>%=36.8*100/40=92%

Nhiệt phân hoàn toàn hỗn hợp MgCO3; CaCO3 rồi cho toàn bộ khí X vào dung dịch thu được ↓ Y và dung dịch Z![]()
![]() Khí X là CO2
Khí X là CO2
CO2 + Ca(OH)2 → CaCO3↓ + H2O
CaCO3↓ + CO2 + H2O → Ca(HCO3)2
→ Kết tủa Y là CaCO3; dung dịch Z là Ca(HCO3)2 → Đáp án đúng là đáp án C

Đáp án B
• Nung 16,8 g ![]() CO2 + 0,18 Ba(OH)2 → 0,17 mol BaCO3↓
CO2 + 0,18 Ba(OH)2 → 0,17 mol BaCO3↓
• TH1: CO2 thiếu
CO2 + Ba(OH)2 → BaCO3↓ + H2O
nCO2 = nBaCO3 = 0,17 mol → nBaCO3 + nCaCO3 = a + b = 0,17
mMgCO3 + mCaCO3 = 84a + 100b = 16,8
→ a = 0,0125 mol; b = 0,1575 mol → mMgCO3 = 0,0125 × 84 = 1,05 gam ![]()
• TH2: CO2 dư
CO2 + Ba(OH)2 → BaCO3↓ + H2O (*)
BaCO3 + CO2 + H2O → Ba(HCO3)2 (**)
Theo (*) nCO2 (*) = 0,18 mol; nBaCO3 = 0,17 mol
Theo (**) nBaCO3 (**) phản ứng = 0,18 - 0,17 = 0,01 mol → nCO2 (**) = 0,02 mol
→ ∑nCO2 = 0,18 + 0,01 = 0,19 mol
→ nBaCO3 + nCaCO3 = a + b = 0,19; mMgCO3 + mCaCO3 = 84a + 100b = 16,8
→ a = 0,1375 mol; b = 0,0525 mol → mMgCO3 = 11,55 gam ![]()

\(n_{CaCO_3}=\dfrac{52,65}{100}=0,5265\left(mol\right)\\ PTHH:CaCO_3\underrightarrow{t^o}CaO+CO_2\\ n_{CO_2\left(TT\right)}=0,5265.95\%=0,500175\left(mol\right)\\ n_{NaOH}=1,8.0,5=0,9\left(mol\right)\\ Vì:2>\dfrac{0,9}{0,500175}>1\)
Vậy: Thu 2 muối Na2CO3 và NaHCO3
\(2NaOH+CO_2\rightarrow Na_2CO_3+H_2O\\ 2x........x.........x\left(mol\right)\\ NaOH+CO_2\rightarrow NaHCO_3\\ y............y........y\left(mol\right)\\ \rightarrow\left\{{}\begin{matrix}x+y=0,500175\\2x+y=0,9\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,399825\\y=0,10035\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}m_{Na_2CO_3}=106.0,399825=42,38145\left(g\right)\\m_{NaHCO_3}=84.0,10035=8,4294\left(g\right)\end{matrix}\right.\)
$CaCO_3 \xrightarrow{t^o} CaO + CO_2$
$n_{CO_2} = n_{CaCO_3\ pư} = \dfrac{52,65}{100}.95\% = 0,5(mol)$
$n_{NaOH} = 0,5.1,8 = 0,9(mol)$
Ta có :
$1 < n_{NaOH} : n_{CO_2} = 0,9 : 0,5 = 1,8 < 2$
nên muối sinh ra là $NaHCO_3(a\ mol) ; Na_2CO_3(b\ mol)$
$2NaOH + CO_2 \to Na_2CO_3 + H_2O$
$NaOH + CO_2 \to NaHCO_3$
Ta có :
$a + 2b = 0,9$
$a + b = 0,5$
Suy ra a = 0,1 ; b = 0,4
$m_{Na_2CO_3} = 0,1.126 = 12,6(gam)$
$m_{NaHCO_3} = 0,4.84 = 33,6(gam)$

nCaCO3 = 0,5265 mol
mà H = 95% => nCO2 = 0,5 mol
nNaOH = 0,5.1,8= 0,9 mol
ta có nNaOH/nCO2 =1,8 => 2 muối
CaCO3 => CaO + CO2
CO2 + 2NaOH => Na2CO3 + H2O
x------->2x
CO2+ NaOH=> NaHCO3
y------->y
giải hệ x + y = 0,5
2x + y =0,9
=> x= 0,4;y= 0,1
=> mNa2CO3 = 0,4.106 = 42,4 (g)
mNaHCO3 = 0,1.84 = 8,4

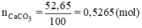
nNaOH = 1,8.0,5 = 0,9(mol)
CaCO3 → CaO + CO2
Từ phương trình suy ra:
nCO2 = nCaCO3 = 0,5265 (mol)
Do hiệu suất phản ứng là 95% nên
⇒ nCO2 thực tế = 95%.0,5265 = 0,500175 (mol)
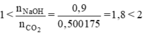
⇒ Tạo ra hỗn hợp 2 muối
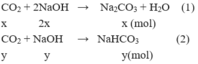
Ta có hệ phương trình:
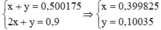
⇒ mNa2CO3 = 0,399825.106 = 42,378 gam
mNaHCO3 = 0,10035.84 = 8,43 gam
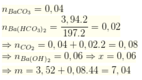
Trong quặng chứa CaCO3.MgCO3 => tỉ lệ mol CaCO3 và MgCO3 là 1:1.
Gọi số mol CaCO3 là x mol.
PV=nRT => \(n=\dfrac{PV}{RT}=\dfrac{0,8\times5,6}{0,082\times273}=0,2mol\)
PTHH:
CaCO3 \(\underrightarrow{t^o}\) CaO + CO2
.....x..........................x
MgCO3 \(\underrightarrow{t^o}\) CaO + CO2
......x..........................x
=> nCO2=2x=0,2 => x=0,1
=> mCaCO3.MgCO3 = 0,1.100+ 0,1.84=18,4g
Hàm lượng CaCO3.MgCO3 trong quặng bằng %=\(\dfrac{18,4}{20}.100=92\%\)