Dẫn 6,72 lít hỗn hợp khí gồm CH4, C2H4 và C2H2 vào dung dịch Br2 dư, sau khi phản ứng hoàn toàn thấy có 2,24 lít khí bay ra và 48 gam Br2 đã tham gia phản ứng. Tính phần trăm khối lượng từng khí có trong hỗn hợp ban đầu?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nhh khí = 2,24/22,4 = 0,1 (mol)
nC2H4 = 1,4/28 = 0,05 (mol)
%VC2H4 = 0,05/0,1 = 50%
%VC2H6 = 100% - 50% = 50%

\(n_{Br_2}=\dfrac{8}{160}=0.05\left(mol\right)\)
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
\(0.05......0.05\)
\(V_{C_2H_4}=0.05\cdot22.4=1.12\left(l\right)\)
\(V_{CH_4}=20-1.12=18.88\left(l\right)\left(mol\right)\)
\(\%V_{C_2H_4}=\dfrac{1.12}{20}\cdot100\%=5.6\%\)
\(\%V_{CH_4}=100-5.6=94.4\%\)

a, \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
b, \(n_{Br_2}=\dfrac{16}{160}=0,1\left(mol\right)\)
\(n_{C_2H_4}=n_{Br_2}=0,1\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{C_2H_4}=\dfrac{0,1.22,4}{3,36}.100\%\approx66,67\%\\\%V_{CH_4}\approx33,33\%\end{matrix}\right.\)

Đáp án D
« Nhận xét “tinh tế”: 0,12 mol Br2 sẽ phản ứng với 0,12 mol pC=C trong X.
® Nếu thay 0,12 mol Br2 bằng 0,12 mol H2 thì sẽ thu được X gồm các hiđrocacbon no và H2.
® Thực hiện thì lúc này có 6,56 gam hỗn hợp X dạng CnH2n + 2 (trường hợp H2 ứng với n = 0).
Giả sử khối lượng 0,1 mol X gấp k lần 6,32 gam X. Thêm 0,12k mol H2 vào các nối đôi C=C trong 0,1 mol X không làm thay đổi số mol X, chỉ thay đổi số H và khối lượng X mà thôi.
« Giải đốt:
![]()
Biết luôn số mol H2O vì lúc này tương quan đốt:
![]()
Bảo toàn C, H ta có
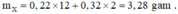
6 , 56 ÷ 3 , 28 = 2 ® tương ứng k = 0,5; nghĩa là lượng 0,12k mol H2 là 0,06 mol.
Theo đó:
![]()

PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
\(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
Gọi: \(\left\{{}\begin{matrix}n_{C_2H_4}=x\left(mol\right)\\n_{C_2H_2}=y\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow x+y=\dfrac{2,24}{22,4}=0,1\left(mol\right)\left(1\right)\)
\(n_{Br_2}=n_{C_2H_4}+2n_{C_2H_2}=x+2y=\dfrac{24}{160}=0,15\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow x=y=0,05\left(mol\right)\)
\(\Rightarrow\%V_{C_2H_4}=\%V_{C_2H_2}=\dfrac{0,05.22,4}{2,24}.100\%=50\%\)

a)
PTHH: C2H2 + 2Br2 --> C2H2Br4
Khí thoát ra là CH4
\(n_{CH_4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
\(n_{C_2H_2}=\dfrac{6,72}{22,4}-0,2=0,1\left(mol\right)\)
\(\left\{{}\begin{matrix}\%m_{CH_4}=\dfrac{0,2.16}{0,2.16+0,1.26}.100\%=55,17\%\\\%m_{C_2H_2}=\dfrac{0,1.26}{0,2.16+0,1.26}.100\%=44,83\%\end{matrix}\right.\)
b)
PTHH: C2H2 + 2Br2 --> C2H2Br4
0,1--->0,2
=> mBr2 = 0,2.160 = 32 (g)






\(n_{CH_4}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Gọi số mol C2H4, C2H2 là a, b (mol)
=> \(a+b=\dfrac{6,72}{22,4}-0,1=0,2\left(mol\right)\) (1)
\(n_{Br_2}=\dfrac{48}{160}=0,3\left(mol\right)\)
PTHH: C2H4 + Br2 --> C2H4Br2
a--->a
C2H2 + 2Br2 --> C2H2Br4
b---->2b
=> a + 2b = 0,3 (2)
(1)(2) => a = 0,1 (mol); b = 0,1 (mol)
\(\%m_{CH_4}=\dfrac{0,1.16}{0,1.16+0,1.28+0,1.26}.100\%=22,857\%\)
\(\%m_{C_2H_4}=\dfrac{0,1.28}{0,1.16+0,1.28+0,1.26}.100\%=40\%\)
\(\%m_{C_2H_2}=\dfrac{0,1.26}{0,1.16+0,1.28+0,1.26}.100\%=37,143\%\)