1. Tính số mol kali clorat (KClO3) và số mol kali pemanganat (KMnO4) cần dùng để điều chế thể tích oxi (đktc) đủ để đốt cháy hoàn toàn.
a) 18g cacbon
b) 4,4g lưu huỳnh
c) 1,35g bột nhôm
2. Nung thủy ngân oxit (HgO) được thủy ngân và oxi
a) Viết pthh
b) P.ứng trên thuộc loại p.ứng nào?
c) Nung 21,6g thủy ngân oxit. Tính thể tích oxi (đktc) và khối lượng thủy ngân thu được.
3. Điều chế kẽm oxit (ZnO) bằng cách đốt kẽm trong oxi.
a) Tính thể tích oxi (đktc) cần dùng để điều chế 40,5g kẽm oxit
b) Muốn có thể tích oxi nói trên cần phải phân hủy bao nhiêu gam kali clorat.
4. Khí metan cháy trong oxi tạo thành khí cacbonic và hơi nước.
a) Tính thể tích oxi cần thiết để đốt cháy hoàn toàn 11,2 lít metan.
b) Tính thể tích khí cacbonic tạo thành trong p.ứng trên.

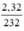 = 0,01 mol.
= 0,01 mol.
2)
a) PTHH: 2HgO -to-> 2Hg + O2
b) Phản ứng trên có duy nhất một chất tham gia và có 2 chất sản phẩm tức phản ứng này thuộc phản ứng phân hủy (theo định nghĩa phản ứng phân hủy).
c) Ta có:
nHgO=21,6217≈0,1(mol)
Theo PTHH và đề bài, ta có:
nO2=0,12=0,05(mol)
Thể tích khí O2 (ở đktc):
VO2(đktc)=0,05.22,4=1,12(l)
Theo PTHH và đề bài, ta có:
nHg=nHgO=0,1(mol)
Khối lượng thủy ngân thu được:
mHg=0,1.201=20,1(g)
3)
a)Pt 2Zn + O2 to→ 2 ZnO
-nZnO=40.581=0.5(mol)
-Theo pt thì nO2=12 nZnO=0.25(mol)
=>VO2=0,25.22.4=5.6(l)
b) Pt : 2KClO3to→to→ 2KCl + 3O2
-Theo phương trình : nKClO3=2\3 nO2=1\6(mol)
=>mKClO3=1/6.122.5=24.42(g)
4)
PTHH: CH4 + 2O2 -to-> CO2 + 2H2O
a) Ta có:
nCH4=11,2\22,4=0,5(mol)
Theo PTHH và đề bài, ta có:
nO2=2.nCH4=2.0,5=1(mol)=>VO2(đktc)=1.22,4=22,4(l)
b) 2KClO3 -to-> 2KCl + 3O2
Theo câu a, ta có:
nO2=1(mol)
Theo PTHH và đề bài, ta có:
nKClO3=2.1\3≈0,667(mol)
Khối lượng KClO3 đã phản ứng:
mKClO3=0,667.122,5=81,7075(g)
Vậy...
Bài 2 :
a) PTHH: 2HgO --> 2Hg + O2
b) Phản ứng trên có duy nhất một chất tham gia và có 2 chất sản phẩm tức phản ứng này thuộc phản ứng phân hủy (theo định nghĩa phản ứng phân hủy).
c) Ta có:
nHgO=21,6217≈0,1(mol)
Theo PTHH và đề bài, ta có:
nO2=0,12=0,05(mol)
Thể tích khí O2 (ở đktc):
VO2(đktc)=0,05.22,4=1,12(l)
Theo PTHH và đề bài, ta có:
nHg=nHgO=0,1(mol)
Khối lượng thủy ngân thu được:
mHg=0,1.201=20,1(g)
3)
a)Pt 2Zn + O2 to→ 2 ZnO
-nZnO=40.581=0.5(mol)
-Theo pt thì nO2=12 nZnO=0.25(mol)
=>VO2=0,25.22.4=5.6(l)
b) Pt : 2KClO3to→to→ 2KCl + 3O2
-Theo phương trình : nKClO3=2\3 nO2=1\6(mol)
=>mKClO3=1/6.122.5=24.42(g)
4)
PTHH: CH4 + 2O2 -to-> CO2 + 2H2O
a) Ta có:
nCH4=11,2\22,4=0,5(mol)
Theo PTHH và đề bài, ta có:
nO2=2.nCH4=2.0,5=1(mol)=>VO2(đktc)=1.22,4=22,4(l)
b) 2KClO3 -to-> 2KCl + 3O2
Theo câu a, ta có:
nO2=1(mol)
Theo PTHH và đề bài, ta có:
nKClO3=2.1\3≈0,667(mol)
Khối lượng KClO3 đã phản ứng:
mKClO3=0,667.122,5=81,7075(g)