Bài 1: Nhiệt phân hoàn toàn x gam Fe(OH)3 đến khối lượng không đổi thu 24 gam chất rắn.Giá trị bằng số của x là ?
Bài 2: Cho 500ml dung dịch NaCl 2M tác dụng với 600 mlm dung dịch AgNO3 2M. Khối lượng kết tuả thu được là ?
Bài 3: Phần trăm về khối lượng của nguyên tố N trong (NH2)2CO là?
Bài 4: Hoà tan 50 gam CaCO3 vào dung dịch axit clohirdic dư . BIết hiệu suất của phản ứng là 85 %. Thể tích của khí CO2 (đktc) thu được là?
Bài 5: Hoà tan hết 5,6 gam CaCO3 vào dung sịch HCl 14,6%. Khối lượng dung dịch HCl đã dùng là?
Bài 6: Khử hoaǹ toàn 16 gam Fe2O3 bằng CO dư , sản phẩm khí thu được cho đi vào dd Ca(OH)2 dư thu được a gam kết tuả .Giá trị của a là?







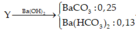
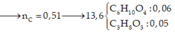
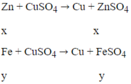
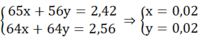


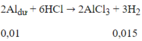

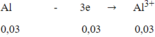
Bài 1: \(PT:2Fe\left(OH\right)_3\underrightarrow{t^0}Fe_2O_3+3H_2O\)
Chất rắn là Fe2O3
=> \(n_{Fe_2O_3}=\dfrac{m}{M}=\dfrac{24}{160}=0,15\left(mol\right)\)
=> nFe(OH)3=2.nFe2O3=0,3(mol)
=> mFe(OH)3=n.M=0,3.107=32,1(g)
Bài 1:
2Fe(OH)3\(\overset{t^0}{\rightarrow}\)Fe2O3+3H2O
\(n_{Fe_2O_3}=\dfrac{24}{160}=0,15mol\)
\(n_{Fe\left(OH\right)_3}=2n_{Fe_2O_3}=0,15.2=0,3mol\)
x=\(m_{Fe\left(OH\right)_3}=0,3.107=32,1gam\)