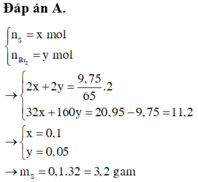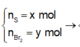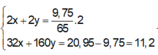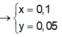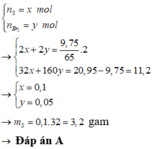Đốt cháy hh gồm 13gam Zn và 4,8 gam S trong 1 bình kín thu dc chất rắn X Tính khối lượng có trong các chất rắn X.cho X tác dụng vừa đủ vs đ HCl vừa thu dc V(1)(đkc) khí A .tìm giá trị của V cho các phản ứng xảy ra hoàn toàn
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a)
$Zn + S \xrightarrow{t^o} ZnS$
$n_{Zn} =\dfrac{9,75}{65} = 0,15 > n_S = \dfrac{3,84}{32} = 0,12$ nên Zn dư
$n_{ZnS} = n_S = 0,12(mol)$
$m_{ZnS} = 0,12.97 = 11,64(gam)$
$n_{Zn\ dư} = 0,15 - 0,12 = 0,03(mol)$
$m_{Zn\ dư} = 0,03.65 = 1,95(gam)$
b)
$Zn + 2HCl \to ZnCl_2 + H_2$
$ZnS + 2HCl \to ZnCl_2 + H_2S$
$n_{khí} = n_{H_2} + n_{H_2S} = n_{Zn\ dư} + n_{ZnS} = 0,15(mol)$
$V = 0,15.22,4 = 3,36(lít)$
\(n_{Zn}=\dfrac{9.75}{65}=0.15\left(mol\right)\)
\(n_S=\dfrac{3.84}{32}=0.12\left(mol\right)\)
\(Zn+S\underrightarrow{^{^{t^0}}}ZnS\)
Lập tỉ lệ :
\(\dfrac{0.15}{1}>\dfrac{0.12}{1}\Rightarrow Zndư\)
\(a.\)
\(m_X=m_{ZnS}+m_{Zn\left(dư\right)}=0.12\cdot97+\left(0.15-0.12\right)\cdot65=13.59\left(g\right)\)
\(b.\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(0.03..................................0.03\)
\(ZnS+2HCl\rightarrow ZnCl_2+H_2S\)
\(0.12.................................0.12\)
\(V_{khí}=0.03\cdot22.4+0.12\cdot22.4=3.36\left(l\right)\)

a) Đặt \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow56a+27b=1,93\) (1)
Ta có: \(n_S=\dfrac{1,28}{32}=0,04\left(mol\right)\)
Bảo toàn electron: \(2a+3b=0,08\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=\dfrac{121}{3800}\left(mol\right)\\b=\dfrac{31}{5700}\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=\dfrac{121}{3800}\cdot56\approx1,78\left(g\right)\\m_{Al}\approx0,15\left(g\right)\end{matrix}\right.\)
b) Bảo toàn nguyên tố: \(\Sigma n_{H_2S}=n_{FeS}+3n_{Al_2S_3}=n_{Fe}+6n_{Al}=\dfrac{49}{760}\left(mol\right)\)
\(\Rightarrow V_{H_2S}=\dfrac{49}{760}\cdot22,4\approx1,44\left(l\right)\)

Gọi \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Zn}=y\left(mol\right)\end{matrix}\right.\)
\(n_{HCl}=0,2\cdot4=0,8mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(x\) \(\rightarrow\) \(3x\) \(x\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(y\) \(\rightarrow\) \(2y\) \(y\)
\(\Rightarrow\left\{{}\begin{matrix}27x+65y=11,9\\3x+2y=0,8\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
a)\(\%m_{Al}=\dfrac{0,2\cdot27}{11,9}\cdot100\%=45,38\%\)
\(\%m_{Zn}=100\%-45,38\%=54,62\%\)
b)\(\Sigma n_{H_2}=\dfrac{3}{2}x+y=\dfrac{3}{2}\cdot0,2+0,1=0,4mol\)
\(V_{H_2}=0,4\cdot22.4=8,96l\)

a, \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có: \(n_{Fe}=\dfrac{14}{56}=0,25\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{HCl}=2n_{Fe}=0,5\left(mol\right)\\n_{H_2}=n_{Fe}=0,25\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow V_{H_2}=0,25.24,79=6,1975\left(l\right)\)
\(a=C_{M_{HCl}}=\dfrac{0,5}{0,1}=5\left(M\right)\)
b, Theo PT: \(n_{FeCl_2}=n_{Fe}=0,25\left(mol\right)\)
Ta có: \(n_{AgNO_3}=0,4.1,3=0,52\left(mol\right)\)
PT: \(2AgNO_3+FeCl_2\rightarrow Fe\left(NO_3\right)_2+2AgCl_{\downarrow}\)
______0,5______0,25______0,25________0,5 (mol)
\(AgNO_3+Fe\left(NO_3\right)_2\rightarrow Fe\left(NO_3\right)_3+Ag_{\downarrow}\)
0,02______0,02________0,02________0,02 (mol)
⇒ m = mAgCl + mAg = 0,5.143,5 + 0,02.108 = 73,91 (g)
- Dd sau pư gồm: Fe(NO3)3: 0,02 (mol) và Fe(NO3)2: 0,25 - 0,02 = 0,23 (mol)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{Fe\left(NO_3\right)_3}}=\dfrac{0,02}{0,1+0,4}=0,04\left(M\right)\\C_{M_{Fe\left(NO_3\right)_2}}=\dfrac{0,23}{0,1+0,4}=0,46\left(M\right)\end{matrix}\right.\)
\(Fe+2HCl->FeCl_2+H_2\\ a.V=\dfrac{14}{56}\cdot22,4=5,6\left(L\right)\\ a=\dfrac{\dfrac{14}{56}\cdot2}{0,1}=5\left(M\right)\\ b.n_{AgNO_3}=0,4\cdot1,3=0,52mol\\ FeCl_2+AgNO_3->Fe\left(NO_3\right)_2+AgCl\\ Fe\left(NO_3\right)_2+AgNO_3->Ag+Fe\left(NO_3\right)_3\\ m=0,25\cdot143,5+0,25\cdot108=62,875\left(g\right)\\ C_{M\left(AgNO_3\right)}=\dfrac{0,02}{0,5}=0,04M\\ C_{M\left(Fe\left(NO_3\right)_3\right)}=\dfrac{0,25}{0,5}=0,5M\)