Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 1 ⅕ dd A có mH2O=92,7/5=18,54g
HCl + AgNO3 =>AgCl + HNO3
0,04 mol<=0,04 mol<=0,04 mol
nAgCl=5,74/143,5=0,04 mol
mHCl=0,04.36,5=1,46g
mddHCl=0,04.36,5+18,54=20g
C%dd HCl=C%dd A=1,46/20.100%=7,3%
Bài 2
TH1 2 Halogen là F và Cl
n ktủa=nAgCl=4,75/143,5=0,033 mol>0,03 mol hh 2 muối
=>loại
TH2 2 Halogen không phải F và Cl
Gọi Hal trung bình là Z
nAgZ=4,75/(108+Z) mol
nhh muối=0,03 mol
NaZ + AgNO3 =>AgZ + NaNO3
0,03 mol =>0,03 mol
=>4,75/0,03=108+Z=>Z=50,33g/mol
Mà 2 halogen ở 2 chu kì kế tiếp nhau
=>2 halogen là Cl và Br

\(a.n_{CaCl_2}=0,1\left(mol\right)\\ CaCl_2+2AgNO_3\rightarrow Ca\left(NO_3\right)_2+2AgCl\\ n_{AgCl}=2n_{CaCl_2}=0,2\left(mol\right)\\ \Rightarrow m_{AgCl}=0,2.143,5=28,7\left(g\right)\\ b.n_{Ca\left(NO_3\right)_2}=n_{CaCl_2}=0,1\left(mol\right)\\ \Rightarrow CM_{CaCl_2}=\dfrac{0,1}{0,1}=1M\)

1/ Gọi x, y lần lượt là số mol của Na2CO3 và KHCO3.
Khi cho từ từ HCl vào dung dịch A thì các phản ứng xảy ra lần lượt là :
CO3^2- + H^+ => HCO3-
x ---------> x ----------> x
HCO3^- + H+ => H2O + CO2.
0,045 <--- 0,045 <-------- 0,045
.........HCO3^- + OH- => CO3^2- + H2O.
x+y - 0,045 -------------> x+y-0,045.
Giải hệ: x+y-0,045 = 29,55/197; n HCl = x+ 0,045 = 0,15.
=> x = 0,105 ; y = 0,09.
2/ Nồng độ của HCO3- , CO3^2- lần lượt là 0,225 M; 0,2625 M.
3/ Cho từ từ dung dịch A vào bình đựng 100 ml dung dịch HCl 1,5 M => Các phản ứng xảy ra đồng thời:
CO3^2- + 2 H^+ => H2O + CO2.
HCO3- + H+ => H2O + CO2.
Do tỉ lệ trong hỗn hợp : n CO3^2-/ n HCO3- = 7/6 => 7x*2+6x = 0,15 => x=0,0075.
=> V = 2,184 lít.

Coi hai kim loại A,B là R có số mol là a
\(R + 2HCl \to RCl_2 + H_2\\ RCl_2 + 2AgNO_3 \to 2AgCl + 2R(NO_3)_2\)
Theo đề bài , ta có :
0,25 < 2a < 0,35
\(\Leftrightarrow 0,125 < a < 0,175\\ \Leftrightarrow 0,125R < a.R < 0,175R\\ \Leftrightarrow 0,125 R < 4,4 < 0,175R\\ \Leftrightarrow \dfrac{4,4}{0,175} = 25,14 < R < \dfrac{4,4}{0,125} = 35,2\)
Do đó hai kim loại cần tìm là Magie(M = 24) và Canxi (M = 40)

Chọn D
Gọi N 2 C O 3 (x mol) và N a H C O 3 ( y mol)
Nhỏ từ từ HCl vào hỗn hợp xảy ra pư theo thứ tự:
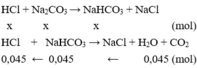


\(n_{H_2}=\dfrac{1}{22,4}=\dfrac{5}{112}\left(mol\right)\)
\(n_{Cl_2}=\dfrac{0,672}{22,4}=0,03\left(mol\right)\)
PTHH: H2 + Cl2 --as--> 2HCl
Xét tỉ lệ: \(\dfrac{\dfrac{5}{112}}{1}>\dfrac{0,03}{1}\) => Hiệu suất tính theo Cl2
\(n_{AgCl}=\dfrac{7,175}{143,5}=0,05\left(mol\right)\)
Bảo toàn Cl: \(n_{Cl_2\left(pư\right)}=0,025\left(mol\right)\)
\(H\%=\dfrac{0,025}{0,03}.100\%=83,33\%\)

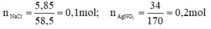
a) Phương trình hóa học của phản ứng:
NaCl + AgNO3 → AgCl↓ + NaNO3
Theo pt: nAgNO3 pư = nAgCl = nNaCl = 0,1 mol
b) Vdd = 300 + 200 = 500 ml
nAgNO3 dư = 0,2 – 0, 1 = 0,1 mol; nNaNO3 = nNaCl = 0,1 mol
CM(NaNO3) = CM(AgNO3) = 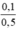 = 0,2 mol/l.
= 0,2 mol/l.

