Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
Coi V dd HCl = 100(ml)
m dd HCl = 1,25.100 = 125(gam)
n HCl = 125.7,3%/36,5 = 0,25(mol)
[H+ ] = [Cl- ] = CM HCl = 0,25/0,1 = 2,5M
b)
n Al = 0,235(mol)
2Al + 6HCl $\to$ 2AlCl3 + 3H2
n HCl pư = 3n Al = 0,705(mol)
n HCl dư = 0,4.2 - 0,705 = 0,095(mol)
[H+ ] = CM HCl dư = 0,095/0,4 = 0,2375M
pH = -log([H+ ]) = 0,624

a)
$n_{CaCO_3} = 0,12(mol) ; n_{HCl} = 0,6(mol)
\(CaCO_3+2HCl\text{→}CaCl_2+CO_2+H_2O\)
Ban đầu 0,12 0,6 (mol)
Phản ứng 0,12 0,24 (mol)
Sau pư 0 0,36 0,12 (mol)
$V = 0,12.22,4 = 2,688(lít)$
b)
$n_{Cl^-} = 0,6(mol) ; n_{H^+} = 0,36(mol)$
$n_{Ca^{2+}} = 0,12(mol)$
$[Cl^-] = \dfrac{0,6}{0,2} = 3M$
$[H^+] = \dfrac{0,36}{0,2} = 1,8M$
$[Ca^{2+}] = \dfrac{0,12}{0,2} = 0,6M$
a,\(n_{CaCO_3}=\dfrac{12}{100}=0,12\left(mol\right);n_{HCl}=0,2.3=0,6\left(mol\right)\)
PTHH: CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Mol: 0,12 0,12
Ta có: \(\dfrac{0,12}{1}< \dfrac{0,6}{2}\)⇒ HCl dư,CaCO3 pứ hết
\(V_{CO_2}=0,12.22,4=2,688\left(l\right)\)

Đáp án D
nMg = 0,15 mol ; nHNO3 = 0,4 mol ; nX = 0,02 mol
mX = 3,6 – 3,04 = 0,56g => MX = 28g (N2)
Bảo toàn e : nNH4NO3 = 1/8 (0,15.2 – 0,02.10) = 0,0125 mol
Bảo toàn Nito : nHNO3(Y) = 0,4 – (2nMg + 2nN2 + 2nNH4NO3) = 0,035 mol
nNaOH = nHNO3 (Y) + 2nMg + nNH4NO3 = 0,3475 mol
=> Vdd NaOH = 173,75 ml

Để có pH = 1 thì nồng độ HCl phải bằng 1. 10 - 1 mol/l. Vậy phải pha loãng 4 lần dung dịch HCl 0,4M, nghĩa là pha thêm 750 ml nước.

Hoà tan hoàn toàn hỗn hợp Na2O, Al2O3 vào nước được dung dịch trong suốt X (NaOH dư,NaAlO2)
Chú ý thứ tự các phản ứng khi thêm dung dịch HCl vào dung dịch X
HCl + NaOH → NaCl + H2O (1)
NaAlO2+ HCl+ H2O → NaCl + Al(OH)3 (2)
Al(OH)3 + 3HCl → AlCl3 + 3H2O (3)
Khi thêm 0,1 mol HCl thì bắt đầu xuất hiện kết tủa → nNaOH dư = 0,1 mol (xảy ra (1))
Khi thêm 0,2 mol HCl thì xảy ra (1), (2) ( lượng AlO2- trong pt (2)dư )
→ nkết tủa = nH+ phản ứng (2) = 0,2 - 0,1 = 0,1 mol → a = 7,8 gam. Loại B,D
Khi thêm 0,6 mol HCl xảy ra hiện tượng hòa tan kết tủa (xảy ra cả 3 phương trình)
→ 4×nAlO2- = 3nkết tủa + (nH+ -0,1) → nAlO2- = 0,2 mol
Vậy NaAlO2 0,2 mol, NaOH dư 0,1 mol → m= mAl2O3 + mNa2O = 0,1×102 + 0,15×62 = 19,5 gam
Đáp án A
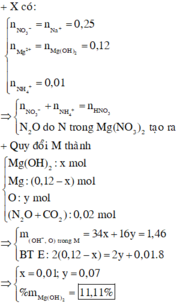
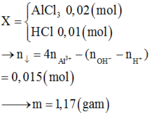
Mg + 2HCl → M g C l 2 + H 2
1 2 (mol)
0,005 0,01 mol
Số mol HCl còn lại sau phản ứng: 0,02 - 0,01 = 0,01 (mol).
Từ đó, số mol HCl trong 1000 ml là 0,1 mol, nghĩa là sau phản ứng
[HCl] = 0,1M = 1. 10 - 11 . 10 - 1 M.
Vậy pH = 1.