Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 1:
PT ion: \(H^++OH^-\rightarrow H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{OH^-}=0,6\cdot0,4+0,6\cdot0,3\cdot2=0,6\left(mol\right)\\n_{H^+}=0,2\cdot2,6=0,52\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\) H+ hết, OH- còn dư \(\Rightarrow n_{OH^-\left(dư\right)}=0,08\left(mol\right)\)
\(\Rightarrow\left[OH^-\right]=\dfrac{0,08}{0,6+0,2}=0,1\left(M\right)\) \(\Rightarrow pH=14+log\left(0,1\right)=13\)
Bài 2:
PT ion: \(H^++OH^-\rightarrow H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{OH^-}=0,3\cdot1,6=0,48\left(mol\right)\\n_{H^+}=0,2\cdot1\cdot2+0,2\cdot2=0,8\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\) OH- hết, H+ còn dư \(\Rightarrow n_{H^+\left(dư\right)}=0,32\left(mol\right)\)
\(\Rightarrow\left[H^+\right]=\dfrac{0,32}{0,2+0,3}=0,64\left(M\right)\) \(\Rightarrow pH=-log\left(0,64\right)\approx0,19\)

Đáp án B
nHCl bđ = V. CM = 10.10-3. 10-pH = 10-5
pHsau = 4 => CM sau = 10-4 M
=> Vsau = n : CM = 0,1 lit = 100 ml
=> Vthêm = 100 – 10 = 90 ml

$n_{HCl} = 0,01.10^{-3}(mol)$
$\Rightarrow V_{dd\ HCl\ pH = 4} = \dfrac{0,01.10^{-3}}{10^{-4}} = 0,1(lít)$
$\Rightarrow V_{H_2O} = 0,1 - 0,01 = 0,09(lít)$

a, \(n_{OH^-}=10^{-1}.V_A\left(mol\right)\)
\(n_{H^+}=10^{-2}.V_B\left(mol\right)\)
\(n_{OH^-dư}=10^{-2}.\left(V_A+V_B\right)\left(mol\right)\)
Ta có: \(n_{OH^-}-n_{OH^-dư}=n_{H^+}\)
\(\Leftrightarrow10^{-1}.V_A-10^{-2}.\left(V_A+V_B\right)=10^{-2}.V_B\)
\(\Leftrightarrow0,09V_A=0,02V_B\)
\(\Rightarrow\dfrac{V_A}{V_B}=\dfrac{2}{9}\)
b, Ta có: \(\left\{{}\begin{matrix}V_A+V_B=0,55\\\dfrac{V_A}{V_B}=\dfrac{2}{9}\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}V_A=0,1\left(l\right)\\V_B=0,45\left(l\right)\end{matrix}\right.\)
\(n_{BaCl_2}=\dfrac{1}{2}n_{Cl^-}=\dfrac{1}{2}n_{H^+}=\dfrac{1}{2}.10^{-2}.0,1=0,0005\left(mol\right)\Rightarrow m_{BaCl_2}=0,104\left(g\right)\)
\(n_{Ba\left(OH\right)_2}=\dfrac{1}{2}n_{OH^-dư}=\dfrac{1}{2}.10^{-2}.0,55=0,00275\left(mol\right)\Rightarrow m_{Ba\left(OH\right)_2}=0,047025\left(g\right)\)
\(\Rightarrow\%m_{Ba\left(OH\right)_2}=\dfrac{0,047025}{0,047025+0,104}.100\%=31,14\%\)
\(\Rightarrow\%m_{BaCl_2}=62,86\%\)

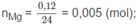
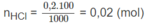
Mg + 2HCl → M g C l 2 + H 2
1 2 (mol)
0,005 0,01 mol
Số mol HCl còn lại sau phản ứng: 0,02 - 0,01 = 0,01 (mol).
Từ đó, số mol HCl trong 1000 ml là 0,1 mol, nghĩa là sau phản ứng
[HCl] = 0,1M = 1. 10 - 11 . 10 - 1 M.
Vậy pH = 1.

pH =3 → [H+] =10^(-3)
HCl → H(+) + Clˉ
10^(-3) ← 10^(-3)
Sau khi pha loãng [H+] =10^(-4) → [HCl] =10^(-4) M
áp dụng phương pháp đường chéo
HCl :10^(-3) .............10^(-4)
.... .. ... .. 10^(-4) .. .. .. .. ..=> 10^(-3)/9.10^(-3) = 0.01/Vnước
Nc : 0 ............... 9.10^(-4)
=> V nc =0.9ml =90 ml
(chính xác 100%)
Để có pH = 1 thì nồng độ HCl phải bằng 1. 10 - 1 mol/l. Vậy phải pha loãng 4 lần dung dịch HCl 0,4M, nghĩa là pha thêm 750 ml nước.