Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Bảo toàn điện tích với dd X ta có:
0,17. 1 = 0,02.1 + 2nBa2+
=> nBa2+ = 0,075 (mol)
Bảo toàn điện tích với dd Y ta có:
2.0,03 + 1.nHCO3- = 0,1.1
=> nHCO3- = 0,04 (mol)
Trộn dd X với Y xảy ra phản ứng:
OH- + HCO3- → CO32- + H2O
0,04 →0,04 → 0,04 (mol)
Ba2+ + CO32- → BaCO3↓
0,07 ←( 0,03+ 0,04) → 0,07 (mol)
=> m↓ = mBaCO3 = 0,07.197= 13,79 (g)

Chọn D
Bảo toàn điện tích có: 0,07 + 3a = 0,12 + 0,02.2 → a = 0,03 mol
Cho X vào hỗn hợp KOH và Ba(OH)2:
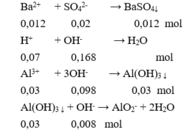
Sau phản ứng thu được kết tủa là:
BaSO 4 0,012 (mol) và Al ( OH ) 3 : 0,03 – 0,008 = 0,022 (mol).
m↓ = 0,012.233 + 0,022.78 = 4,512 gam.

Đáp án C
nBa2+ = 0,012 < 0,02 = nSO42- ⇒ nBaSO4 = nBa2+ = 0,012
m↓ = mBaSO4 + mAl(OH)3 = 3,732g
⇒ nAl(OH)3 = 0,012
H+ + OH- → H2O
0,1 → 0,1 (mol)
Al3+ + 3OH- → Al(OH)3
z → 3z z (mol)
Al(OH)3 + OH- → AlO2- + H2O
Z – 0,12 → z – 0,12 (mol)
nOH- ban đầu = 0,168 = nH+ + 3nAl3+ + nAlO2- = 0,1 + 3z + z – 0,012
⇒ z = 0,02
Bảo toàn điện tích: 3z + 0,1 = t + 0,02.2 ⇒ t =0,12

\(n_{OH^-}=0.12\cdot\left(1.2+0.1\cdot2\right)=0.168\left(mol\right)\)
Trong dung dịch X, bảo toàn điện tích :
\(0.1+3z=t+0.02\cdot2\)
\(\Rightarrow t-3z=0.06\left(1\right)\)
Khi cho dung dịch X và dung dịch Y phản ứng thì :
\(H^++OH^-\rightarrow H_2O\)
\(0.1.......0.1\)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\)
\(0.012.....0.012............0.012\)
=> SO42- dư
\(m_{BaSO_4}=0.012\cdot233=2.796\left(g\right)\)
\(\Rightarrow n_{Al\left(OH\right)_3}=\dfrac{3.732-2.796}{78}=0.012\left(mol\right)\)
\(Al^{3+}+3OH^-\rightarrow Al\left(OH\right)_3\)
\(n_{OH^-}\)phản ứng với \(Al\left(OH\right)_3\)\(=0.168-0.1=0.068\left(mol\right)< 3n_{Al\left(OH\right)_3}\)
\(\Rightarrow n_{Al^{3+}}=\dfrac{n_{Al\left(OH\right)_3}+n_{OH^-}}{4}=\dfrac{0.012+0.068}{4}=0.02\left(mol\right)\)
\(\Rightarrow z=0.02\)
\(\left(1\right):t=0.12\)

$n_{OH^-} = 0,12.1,2 + 0,12.0,1.2 = 0,168(mol)$
$n_{Ba^{2+}} = 0,012 < n_{SO_4^{2-}} = 0,02$ nên $SO_4^{2-}$ dư
$n_{BaSO_4} = n_{Ba^{2+}} = 0,012(mol)$
$\Rightarrow n_{Al(OH)_3} = \dfrac{3,732 - 0,012.233}{78} = 0,012(mol)$
Al3+ + 3OH- → Al(OH)3
z............3z...............z................(mol)
Al(OH)3 + OH- → AlO2- + 2H2O
z-0,012.....z-0,012.................................(mol)
Suy ra: 3z - (z - 0,012) = 0,168
Suy ra: z = 0,078
Bảo toàn điện tích, t = 0,294

Bảo toàn điện tích : 0,1 + 3z = t + 0,02.2 → t-3z = 0,06
Nhận thấy kết tủa gồm BaSO4 : 0,012 mol, Al(OH)3: 0,012 mol
Ta có 3×nkết tủa + nH+ = 0,136 mol < nOH- = 0,168 mol → Xảy ra trường hợp hòa tan kết tủa
H+ + OH- → H2O
0,1 ------> 0,1
Al3+ + 3OH- → Al(OH)3
0,012---0,036 ------> 0,012
Al3+ + 4OH- → Al(OH)4-
0,008----> 0,032
Vậy z= 0,012 + 0,008 =0,02 → t= 0,12. Đáp án B

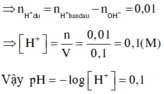

Áp dụng ĐLBT điện tích
0,07 - 2x - 0,1 = 0 =>x=0,015 mol
y + 2z =0,02
trộn X với Y có H+ >< OH- Ba2+ >< SO42-
dd có pH=2 => dd có mt axit => H+ dư OH- hết => \(\left[H^+\right]\)=0,01 => nH+=0,005
H+ + OH- ------> H2O
bđ y 0,1
pư 0,1 <- 0,1
spư y-0,1
=> y - 0,1 = 0,005 => y = 0,105 mol =.> z =
có sai đề k bạn
đề k sai bạn nhé