Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Fe3O4 mới đúng nhé.không phải Fe2SO4
a,\(Fe_3O_4+4H_2\rightarrow3Fe+4H_2O\)
\(n_{Fe3O4}=\frac{4,64}{232}=0,02\left(mol\right)\)
\(\Rightarrow n_{Fe}=0,06\left(mol\right)\)
\(m_{Fe}=0,06.56=3,36\left(g\right)\)
b,\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(n_{H2SO4}=0,05.0,1=0,05\left(mol\right)\)
Tỉ lệ: \(\frac{0,06}{1}>\frac{0,05}{1}\)
Nên Fe dư
\(n_{Fe\left(dư\right)}=0,06-0,05=0,01\left(mol\right)\)
\(m_{Fe\left(dư\right)}=0,01.56=0,56\left(g\right)\)
\(n_{H2}=n_{H2SO4}=0,05\left(mol\right)\)
\(V_{H2}=0,05.22,4=1,12\left(l\right)\)
\(CM_{FeSO4}=\frac{0,05}{0,5}=0,1M\)
\(m_{FeSO4}=0,05.152=7,6\left(g\right)\)

Fe + H2SO4 → FeSO4 + H2 (1)
\(n_{Fe}=\frac{5,6}{56}=0,1\left(mol\right)\)
\(n_{H_2SO_4}=0,5\times0,2=0,1\left(mol\right)\)
Theo PT1: \(n_{Fe}=n_{H_2SO_4}\)
Theo bài: \(n_{Fe}=n_{H_2SO_4}\)
Vì \(1=1\) ⇒ phản ứng vừa đủ
a) Theo PT1: \(n_{H_2}=n_{Fe}=0,1\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,1\times22,4=2,24\left(l\right)\)
b) Theo PT1: \(n_{FeSO_4}=n_{Fe}=0,1\left(mol\right)\)
\(\Rightarrow C_{M_{FeSO_4}}=\frac{0,1}{0,5}=0,2\left(M\right)\)
c) Ta có: \(n_{FeSO_4.7H_2O}=n_{FeSO_4}=0,1\left(mol\right)\)
\(\Rightarrow m_{FeSO_4.7H_2O}=0,1\times278=27,8\left(g\right)\)
d) 4H2 + Fe3O4 \(\underrightarrow{to}\) 3Fe + 4H2O (2)
Theo Pt2: \(n_{Fe_3O_4}=\frac{1}{4}n_{H_2}=\frac{1}{4}\times0,1=0,025\left(mol\right)\)
\(\Rightarrow m_{Fe_3O_4}=0,025\times232=5,8\left(g\right)\)

Câu 33:Một oxit sắt chứa 30% oxi (về khối lượng), đó là:
A.FeO B. Fe2O3 C. Fe3O4 D. Không xác định được
Câu 34:Có thể làm sạch N2 từ hỗn hợp N2, CO2, SO2 bằng cách cho hỗn hợp này đi qua một lượng dư dung dịch:
A.H2SO4 B. NaOH C. CaCl2 D.CuSO4
Câu 35: Cho 31g Na2O tan hoàn toàn trong nước thu được 1 lit dung dịch X . Nồng độ của X là?
A. 1M B. 0,5M C. 2M D. Kết quả khác
Câu 36:Cho 11,2 gam Fe tác dụng hoàn toàn với dung dịch HCl.Thể tích H2 thoát ra ở đktc là:
A.2,24 lít B.4,48 lít C.3,36 lít D.8,96 lít
Câu 37:Hòa tan 3,1g Na2O vào nước được 500ml dung dịch. Dung dịch này có nồng độ mol:
\(n_{Na_2O}=\dfrac{3,1}{62}=0,05\left(mol\right)\\ BTNT\left(Na\right):n_{NaOH}=n_{Na_2O}.2=0,1\left(mol\right)\\ CM_{NaOH}=\dfrac{0,1}{0,5}=0,2M\)
Câu 38.Nung 200kg CaCO3 được 89,6kg CaO. Hiệu suất của phản ứng đạt?
\(CaCO_3-^{t^o}\rightarrow CaO+CO_2\\ n_{CaO\left(lt\right)}=n_{CaCO_3}=\dfrac{200}{100}=2\left(mol\right)\\ m_{CaO\left(lt\right)}=2.56=112\left(kg\right)\\ H=\dfrac{89,6}{112}.100=80\%\)
Câu 39.Khử hoàn toàn 14,4g oxit sắt FexOy bằng CO ở nhiệt độ cao được 11,2g sắt. Công thức oxit sắt trên là:
\(m_{oxit}=m_{Fe}+m_O\\ \Rightarrow m_O=14,4-11,2=3,2\left(g\right)\\ \Rightarrow n_O=0,2\left(mol\right)\\ n_{Fe}=\dfrac{11,2}{56}=0,2\\ Tacó:x:y=0,2:0,2=1:1\\ \Rightarrow CToxit:FeO\)
Câu 40:Để hòa tan hoàn toàn 2,4 gam một oxit kim loại M(hóa trị II) cần dùng vừa đủ 100 ml dung dịch H2SO4 0,6 M,sau phản ứng thu được dung dịch chứa muối MSO4 tương ứng.CTHH của oxit kim loại là:
\(MO+H_2SO_4\rightarrow MSO_4+H_2O\\ n_{MO}=n_{H_2SO_4}=0,06\left(mol\right)\\ M_{MO}=\dfrac{2,4}{0,06}=40\left(đvC\right)\\ \Rightarrow M=24\left(Mg\right)\)
Câu 41:Khử hoàn toàn 17,6 gam hỗn hợp gồm Fe,FeO,Fe2O3 cần 4,48 lít khí CO(đktc).Khối lượng Fe thu được là:
\(BTNT\left(C\right):n_{CO_2}=n_{CO}=0,2\left(mol\right)\\ BTKL:m_{hh}+m_{CO}=m_{Fe}+m_{CO_2}\\ \Rightarrow m_{Fe}=17,6+0,2.28-0,2.44=14,4\left(g\right)\)
Câu 42:Cho 47 gam K2O tan hết vào m gam dung dịch KOH 8% thu được dung dịch KOH 21%.Giá trị của m là:
\(n_{K_2O}=0,5\left(mol\right)\\ BTNT\left(K\right):n_{KOH}=2n_{K_2O}=1\left(mol\right)\\ m_{ddsaupu}=47+m\left(g\right)\\ \Sigma m_{KOH}=1.56+m.8\%\left(g\right)\\ Tacó:C\%_{KOH}=\dfrac{56+m.8\%}{47+m}.100=21\\ \Rightarrow m=354,85\left(g\right)\)

\(n_{\left(C_{17}H_{35}COO\right)_3C_3H_5\left(bđ\right)}=\dfrac{4,45.10^3}{890}=5\left(mol\right)\)
=> \(n_{\left(C_{17}H_{35}COO\right)_3C_3H_5\left(pư\right)}=\dfrac{5.80}{100}=4\left(mol\right)\)
=> \(n_{C_{17}H_{35}COONa}=3.n_{\left(C_{17}H_{35}COO\right)_3C_3H_5\left(pư\right)}=12\left(mol\right)\)
=> \(m_{C_{17}H_{35}COONa}=12.306=3672\left(g\right)\)
=> \(m_{xà.phòng}=\dfrac{3672.100}{62}=\dfrac{183600}{31}\left(g\right)\)

\(a.\left\{{}\begin{matrix}CO_2\\Ca\left(OH\right)_2\end{matrix}\right.\rightarrow CaCO_3\rightarrow Ca\left(HCO_3\right)_2\)
\(b.\) \(n_{CaCO_3}=0,05\left(mol\right)\)
\(PTHH:CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\)
\(\left(mol\right)\) \(0,05\) \(0,05\) \(0,05\)
\(PTHH:CaCO_3+CO_2+H_2O\rightarrow Ca\left(HCO_3\right)_2\)
\(\left(mol\right)\) \(0,05\) \(0,05\) \(0,05\)
\(\rightarrow V_{CO_2}=22,4.\left(0,05+0,05\right)=2,24\left(l\right)\)
\(c.V_{Ca\left(OH\right)_2}=\dfrac{0,05}{0,1}=0,5\left(l\right)\\ m_{Ca\left(HCO_3\right)_2}=0,05.162=8,1\left(g\right)\\ C_{M_{Ca\left(HCO_3\right)_2}}=\dfrac{0,05}{0,5}=0,1\left(M\right)\)
\(d.V_{CO_2}=0,05.22,4=1,12\left(l\right)\\ m_{\downarrow}=5\left(g\right)\)
a) Dẫn từ từ CO2 đến dư vào dung dịch Ca(OH)2 xảy ra phản ứng:
CO2 + Ca(OH)2 → CaCO3 + H2O
CO2 + CaCO3 + H2O → Ca(HCO3)2
Hiện tượng quan sát được: Dung dịch xuất hiện kết tủa trắng tăng dần đến cực đại, sau đó kết tủa tan dần đến hết.
b)\(n_{CaCO_3}=\dfrac{5}{100}=0,05\left(mol\right)\)
CO2 + Ca(OH)2 → CaCO3 + H2O
0,05<---0,05------------0,05
CO2 + CaCO3 + H2O → Ca(HCO3)2
0,05<----0,05-------------------->0,05
Theo PT ta có : \(n_{CO_2}=2n_{CaCO_3}=0,1\left(mol\right)\)
=> \(V_{CO_2}=0,1.22,4=2,24\left(l\right)\)
c)Theo PT ta có : \(n_{Ca\left(HCO_3\right)_2}=n_{CaCO_3}=0,05\left(mol\right)\)
=> \(m_{Ca\left(HCO_3\right)_2}=0,05.162=8,1\left(g\right)\)
Theo PT ta có : \(n_{Ca\left(OH\right)_2}=n_{CaCO_3}=0,05\left(mol\right)\)
\(V_{Ca\left(OH\right)_2}=\dfrac{0,05}{0,1}=0,5\left(l\right)\)
Giả sử thể tích dung dịch thay đổi không đáng kể:
=> \(CM_{Ca\left(HCO_3\right)_2}=\dfrac{0,05}{0,5}=0,1M\)
d) Trường hợp chỉ tạo ra kết tủa :
CO2 + Ca(OH)2 → CaCO3 + H2O
Theo PT : \(n_{CO_2}=n_{CaCO_3}=n_{Ca\left(OH\right)_2}=0,05\left(mol\right)\)
=> \(V_{CO_2}=0,05.22,4=1,12\left(l\right)\)
\(m_{CaCO_3}=0,05.100=5\left(g\right)\)
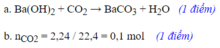

- Khối lượng Fe có trong 8 tấn gang :
\(m_{Fe}=8.10^6.\dfrac{95}{100}=7,6.10^6\left(gam\right)\rightarrow n_{Fe}=\dfrac{7,6.10^6}{56}=135714\left(mol\right)\)
\(Fe_3O_4+4CO\underrightarrow{t^0}3Fe+4CO_2\)
45238..............................135714
\(\rightarrow m_{Fe_3O_4}=45238.232=10,5.10^6=10,5\left(tấn\right)\)
Khối lượng quãng sắt theo lí thuyết ( ứng với hiệu suất 100%)
\(=m_{Fe_3O_4}.\dfrac{100}{80}=10,5.\dfrac{100}{80}=13,1\left(tấn\right)\)
Lượng sắt bị hao hụt trong sản xuất là 1% tương ứng với hiệu suất đạt 99%:
Khối lượng quãng sắt thực tế là : \(=13,1.\dfrac{100}{99}=13,3\left(tấn\right)\)
Cô sẽ hướng dẫn các tính toán để ko phải chuyển đổi Tấn/Kg\(\rightarrow\)gam
A tấn \(\Rightarrow n=\dfrac{A}{M}\left(Mmol\right)\)
A kg\(\Rightarrow n=\dfrac{A}{M}\left(Kmol\right)\)
Chuyển đổi đơn vị 1Mmol=106mol
1Kmol=103mol