Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi số mol Fe phản ứng là a (mol)
PTHH: Fe + CuSO4 --> FeSO4 + Cu
a------------------->a----->a
=> 50 - 56a + 64a = 51
=> a = 0,125 (mol)
=> \(n_{FeSO_4}=0,125\left(mol\right)\)
=> \(m_{FeSO_4}=0,125.152=19\left(g\right)\)
\(Đặt:n_{Fe\left(pứ\right)}=x\left(mol\right)\\ Fe+CuSO_4\rightarrow FeSO_4+Cu\\m_{tăng}=m_{Cu}-m_{Fe\left(pứ\right)}=51-50\\ \Leftrightarrow 64x-56x=1\\ \Rightarrow x=0,125\left(mol\right)\\ n_{FeSO_4}=n_{Fe}=0,125\left(mol\right)\\ \Rightarrow m_{FeSO_4}=0,125.152=19\left(g\right)\)

dd có:
0,02 mol Cu2+
0,02 mol Ag+
sắt dư so với Ag nên trong dd không có Fe3+
Fe + 2Ag+ ==> Fe2+ + 2Ag
0,01 0,02 0,01 0,02
nếu phản ứng này xảy ra tới hết lượng ag trong dung dịch thì khối lượng thanh kim loại là
100 - 0,01.56 + 0,02.108 = 101,6 gam < 101,72 (1)( nhỏ hơn 0,12 gam)
vì cu = 64 và ag = 108 nên sắt phản ứng càng nhiều thì khối lượng thanh sắt tăng càng nhiều
(1) chứng tỏ xảy ra tiếp phản ứng
Fe + Cu2+ ==> Fe2+ + Cu
nếu 1 mol sắt phản ứng thì sẽ klượng thanh kim loại sẽ tăng: 64 - 46 = 8 gam
vậy nhỏ hơn 0,12 gam thì sẽ có 0,015 mol Fe tham gia phản ứng này.
Vậy cộng vào, tổng mol Fe phản ứng là 0,025 mol
suy ra khối lượng fe đã phản ứng là 1,4 gam

PTHH:\(Fe+CuSO_4\rightarrow FeSO_4+Cu\downarrow\)
mCu =mFe tăng = 50.4% = 2(g)
=> nCu =\(\frac{2}{64}\)= 0,03125 mol
Theo PT nFeSO4 = nCu = 0,03125(mol)
CM FeSO4 =\(\frac{0,03125}{0,5}\) = 0,0625(M)
Khối lượng thanh sắt tăng là:
mFe (tăng) =\(\frac{50\cdot4}{100}=2\left(g\right)\)
Gọi khối lượng sắt tác dụng là x
PTHH:
Fe + CuSO4 ----> FeSO4 + Cu
56____________________64
x____________________\(\frac{64x}{56}\)
Theo pt và đề bài, ta có:
\(\frac{64x}{56}-x=2\)
\(\Leftrightarrow64x-56x=56\cdot2\)
\(\Leftrightarrow8x=112\)
\(\Leftrightarrow x=14\left(g\right)\)
\(\rightarrow n_{Fe}=\frac{14}{56}=0,25\left(mol\right)\)
Vậy khối lượng Cu sinh ra là 16 (g)
Đổi: \(500ml=0,5l\)
Theo pt \(\Rightarrow n_{FeSO_4}=n_{Fe}=0,25\left(mol\right)\)
\(\Rightarrow C_MFeSO_4=\frac{0,25}{0,5}=0,5\left(M\right)\)

Giả sử thanh kim loại ban đầu nặng m (g)
Gọi số mol Cu(NO3)2, Pb(NO3)2 pư là a (mol)
TN1:
PTHH: R + Cu(NO3)2 --> R(NO3)2 + Cu
a<-------a------------------>a
=> mgiảm = a.MR - 64a (g)
Và \(m_{giảm}=\dfrac{0,05m}{100}=0,0005m\left(g\right)\)
=> \(a.M_R-64a=0,0005m\) (1)
TN2:
PTHH: R + Pb(NO3)2 --> R(NO3)2 + Pb
a<-------a------------------->a
=> mtăng = 207a - a.MR (g)
Và \(m_{tăng}=\dfrac{7,1.m}{100}=0,071m\left(g\right)\)
=> \(207a-a.M_R=0,071m\) (2)
(1)(2) => \(\dfrac{M_R-64}{207-M_R}=\dfrac{0,0005}{0,071}\)
=> MR = 65 (g/mol)
=> R là Zn

Giả sử có 1 mol Cu
=> mCu(bd) = 64 (g)
\(hh_{sau.pư}=64+\dfrac{1}{6}.64=\dfrac{224}{3}\left(g\right)\)
Gọi số mol Cu pư là a (mol)
PTHH: 2Cu + O2 --to--> 2CuO
a---------------->a
=> hh sau pư chứa \(\left\{{}\begin{matrix}CuO:a\left(mol\right)\\Cu:1-a\left(mol\right)\end{matrix}\right.\)
=> \(80a+64\left(1-a\right)=\dfrac{224}{3}\)
=> a = \(\dfrac{2}{3}\left(mol\right)\)
\(\left\{{}\begin{matrix}\%m_{Cu}=\dfrac{64\left(1-\dfrac{2}{3}\right)}{\dfrac{224}{3}}.100\%=28,57\%\\\%m_{CuO}=\dfrac{80.\dfrac{2}{3}}{\dfrac{224}{3}}.100\%=71,43\%\end{matrix}\right.\)
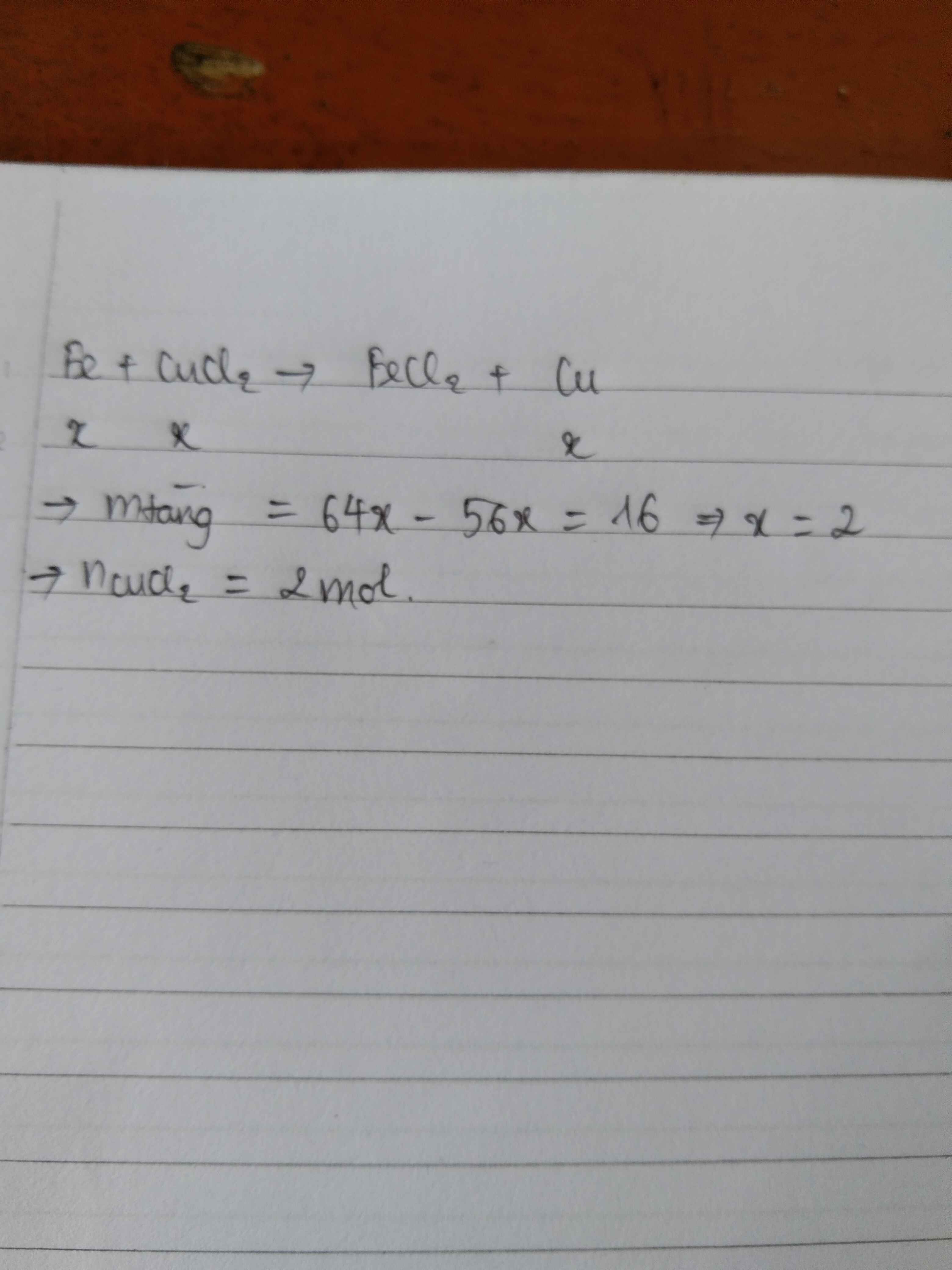
Gọi nCu (p/ư) = a (mol)
PTHH: Cu + 2AgNO3 -> Cu(NO3)2 + 2Ag
nAg = 2a (mol)
mCu (tăng) = mAg (bám vào) - mCu(p/ư) = 2a . 108 - 64a = 30,4
=> a = 0,2 (mol)
=> mAg = 0,2 . 2 . 108 = 43,2 (g)