Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: Fe + H2SO4 ---> FeSO4 + H2
0,25<--------------------------0,25
\(\Rightarrow m_{Fe}=0,25.56=14\left(g\right)\\ \Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{14}{32}.100\%=43,75\%\\\%m_{FeO}=100\%-43,75\%=56,25\%\end{matrix}\right.\)

a)
Mg + H2SO4 --> MgSO4 + H2
2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
Fe + H2SO4 --> FeSO4 + H2
b)
PTHH: Mg + H2SO4 --> MgSO4 + H2
0,1-->0,1---------------->0,1
2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
0,04-->0,06----------------->0,06
Fe + H2SO4 --> FeSO4 + H2
0,15-->0,15------------->0,15
=> a = nH2SO4 = 0,1 + 0,06 + 0,15 = 0,31 (mol)
m = mX - mH2 = 0,1.24 + 0,04.27 + 0,15.56 - 2(0,1 + 0,06 + 0,15)
= 11,26 (g)

Gọi x và y lần lượt là số mol Fe và Al tham gia phản ứng
a/PTHH: Fe + H2SO4 -----> FeSO4 + H2
(mol) x x x x
PTHH: 2Al + 3H2SO4 -----> Al2(SO4)3 + 3H2
(mol) y 3y/2 y/2 3y/2
Suy ra hệ : \(\begin{cases}152x+\frac{342y}{2}=81,7\\56x+27y=19,3\end{cases}\) \(\Leftrightarrow\begin{cases}x=0,2\\y=0,3\end{cases}\)
=> mFe = 0,2.56 = 11,2 (g)
\(\Rightarrow\%Fe=\frac{11,2}{19,3}.100\approx58,03\%\)
%Al = 100% - 58,03% = 41,97%
b/ nH2 = x+3y/2 = 0,2 + 3.0,3/2 = 0,65 (mol)
=> VH2 = 22,4.0,65 = 14,56 (l)
c/ nH2SO4 = x+3y/2 = 0,65 (mol)
=> mH2SO4 = 98.0,65 = 63,7 (g)

2Al+3H2SO4->al2(SO4)3+3H2
Fe+H2SO4->FeSO4+H2
Gọi x,y tương ứng là số mol của Al và Fe:
Ta có: 27x+56y=11 (1)
nH2=0,4 mol
1,5x+y=0,4 (2)
Giải hệ(1),(2):x=0,2;y=0,1
mAl=0,2.27=5,4g
%Al=\(\dfrac{5,4.100}{16,6}\)=32,53%
=>%Fe=67,47%
m H2SO4=0,4.98=39,2g
c) m muối=0,1.342+0,1.152=49,4g

a) Gọi số mol của Mg là x, của Al là y \(\left(x,y>0\right)\)
Ta có: \(24x+27y=7,8\) (*)
PTHH:
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\) (1)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\) (2)
\(n_{H_2\left(1\right)+\left(2\right)}=\dfrac{9,916}{24,79}=0,4\left(mol\right)\)
Theo PTHH: \(n_{H_2\left(1\right)}=n_{Mg}=x\left(mol\right)\); \(n_{H_2\left(2\right)}=\dfrac{3}{2}n_{Al}=\dfrac{3}{2}y\left(mol\right)\)
\(\Rightarrow x+\dfrac{2}{3}y=0,4\) (**)
Từ (*) và (**) ta có hệ:
\(\left\{{}\begin{matrix}24x+27y=7,8\\x+\dfrac{3}{2}y=0,4\end{matrix}\right.\)
Giải hệ ta được: \(\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
\(\Rightarrow\%m_{Al}=\dfrac{27\cdot0,2\cdot100}{7,8}\approx69\%\)
\(\Rightarrow\%m_{Mg}=100\%-69\%=21\%\)
b) \(n_{MgSO_4}=n_{Mg}=0,1\left(mol\right)\); \(n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Al}=0,1\left(mol\right)\)
Tổng khối lượng muối là:
\(m_{MgSO_4}+m_{Al_2\left(SO_4\right)_3}=0,1\cdot120+0,1\cdot342=46,2\)

a, PT: \(R+H_2SO_4\rightarrow RSO_4+H_2\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
b, Ta có: \(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Theo PT: \(n_{H_2SO_4}=n_{H_2}=0,4\left(mol\right)\)
\(\Rightarrow V_{ddH_2SO_4}=\dfrac{0,4}{2}=0,2\left(l\right)\)
Theo ĐLBT KL, có: mKL + mH2SO4 = m muối + mH2
⇒ m muối = 7,8 + 0,4.98 - 0,4.2 = 46,2 (g)
c, Gọi: nR = x (mol) → nAl = 2x (mol)
Theo PT: \(n_{H_2}=n_R+\dfrac{3}{2}n_{Al}=x+\dfrac{3}{2}.2x=0,4\left(mol\right)\Rightarrow x=0,1\left(mol\right)\)
⇒ nR = 0,1 (mol)
nAl = 0,1.2 = 0,2 (mol)
⇒ 0,1.MR + 0,2.27 = 7,8 ⇒ MR = 24 (g/mol)
Vậy: R là Mg.
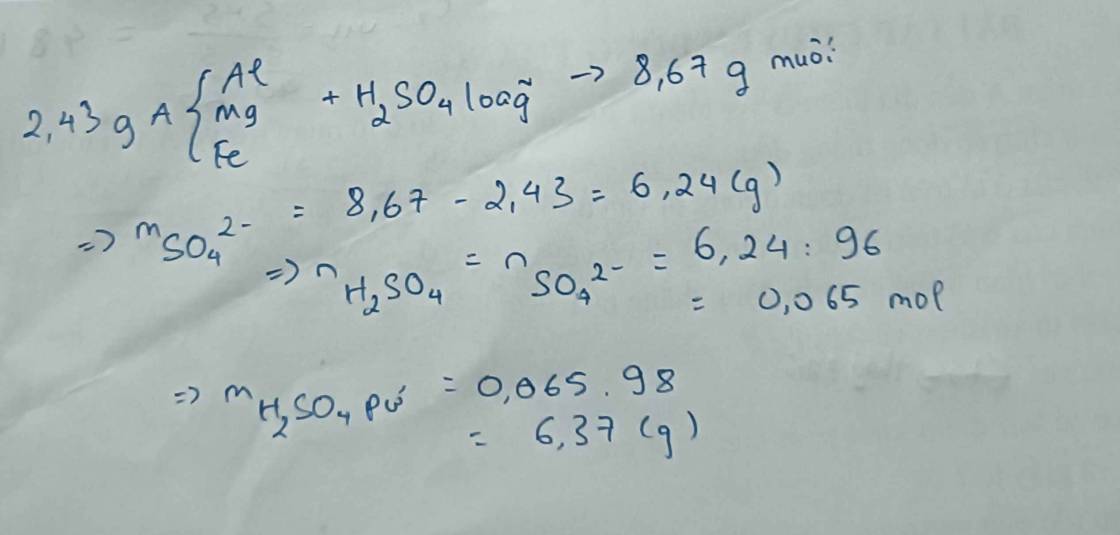
Mg+H2SO4->MgSO4+H2
x-------------------------------x
2Al+3H2SO4->Al2(SO4)3+3H2
y-------------------------------------3\2y
Ta có :
\(\left\{{}\begin{matrix}24x+27y=11,7\\x+\dfrac{3}{2}y=0,6\end{matrix}\right.\)
=>x=0,15 mol , y=0,3 mol
=>m MgSO4=0,15.120=18g
=>m Al2(SO4)3=0,15.342=51,3g
Câu hỏi >?