Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a)\)
\(PTHH: Zn +2AgNO_3 ---> Zn(NO_3)_2 + 2Ag \)
\(nZn = \dfrac{0,65}{65}=0,01(mol)\)
\(nAgNO_3 = 0,1.0,1 = 0,01 (mol)\)
So sánh: \(\dfrac{nZn}{1}=0,01>\dfrac{nAgNO_3}{2} = 0,005\)
=> \(Zn\) dư sau phản ứng, Chọn \(nAgNO_3\) để tính
Theo PTHH: \(nZn \) đã phản ứng \(=0,005(mol)\)
\(=> mZn \)\(= 0,005.65 = 0,325 (g)\)
\(b)\)
Theo PTHH: \(nAg = 0,01 (mol)\)
=> \(mAg = 0,01.108 = 1,08 (g)\)
mZn dư = mZn - mZn phản ứng \(= 0,65 - 0,325 = 0,325 (g)\)
Khi cho Zn tác dụng với AgNO3 thì thanh Zn tan ra kim loại màu bạc là Ag bám lên thanh Zn
=> thanh Zn sau khi lấy ra gồm có Zn dư sau phản ứng và lượng Ag bám lên (được tạo thành sau phản ứng)
\(<=> m = mZn (dư) + mAg \)
\(<=> m = 0,325 + 1,08 = 1,405 (g)\)
Vậy \(m=1,405 (g)\)

\(n_{Zn}=\dfrac{3,25}{65}=0,05\left(mol\right)\)
\(n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right)\)
PTHH: \(Zn+Cl_2\underrightarrow{t^o}ZnCl_2\)
_____0,05-->0,05->0,05______(mol)
\(2Al+3Cl_2\underrightarrow{t^o}2AlCl_3\)
0,1--->0,15-->0,1_____________(mol)
=> m = \(0,05.136+0,1.133,5=20,15\left(g\right)\)
\(V_{Cl_2}=\left(0,05+0,15\right).22,4=4,48\left(l\right)\)
Một cách hơi khác nha ;-;
\(n_{Zn}=\dfrac{m}{M}=0,05\left(mol\right)n_{Al}=\dfrac{m}{M}=0,1\left(mol\right)\)
\(Bte:2n_{Cl_2}=2n_{Zn}+3n_{Al}=0,4\)
\(\Rightarrow n_{Cl_2}=0,2\left(mol\right)\)
\(\Rightarrow V_{Cl_2}=n.22,4=4,48\left(l\right)\)
Ta có : \(m_M=m_{KL}+m_{Cl}=3,25+2,7+0,2.71=20,15\left(g\right)\)
Vậy ..

Ta có: \(m_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\) \(\Rightarrow m_{H_2}=0,2\cdot2=0,4\left(g\right)\)
\(\Rightarrow m_{dd\left(sau.pư\right)}=m_{hh}+m_{ddH_2SO_4}-m_{H_2}=309,6\left(g\right)\)
\(\Rightarrow a=309,6-300=9,6\left(g\right)\)

Thể tích khí hiđro :
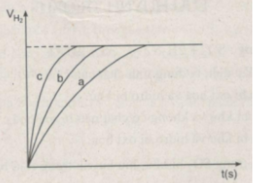
Sau các thí nghiệm, kẽm còn dư. Như vậy, thể tích khí hiđro được sinh ra phụ thuộc vào lượng H 2 SO 4 tham gia phản ứng
n H 2 = n H 2 SO 4 = 2.50/1000 = 0,1 mol
Thể tích khí hiđro ở điều kiện phòng là :
V H 2 = 0,1 x 24 = 2,4l = 2400 cm 3
Ta ghi số 2400 cm 3 trên trục y, nơi giao điểm giữa trục y và đường ngang của 3 đường cong kéo dài (nét chấm trên đồ thị).

a)
Gọi $n_{Zn} = a(mol) ; n_{Al} = b(mol) \Rightarrow 65a + 27b = 11,9(1)$
$Zn + 2HCl \to ZnCl_2 + H_2$
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
Theo PTHH :
$n_{H_2} = a + 1,5b = \dfrac{8,96}{22,4} = 0,4(2)$
Từ (1)(2) suy ra : a = 0,1; b = 0,2
$m_{Zn} = 0,1.65 = 6,5(gam)$
$m_{Al} = 0,2.27 = 5,4(gam)$
b) $n_{HCl} = 2n_{H_2} = 0,8(mol)$
$C\%_{HCl} = \dfrac{0,8.36,5}{125}.100\% = 23,36\%$




a) pt: Zn + 2AgNO3 \(\rightarrow\) Zn(NO3)2 + 2Ag
Ta có \(\dfrac{n_{Zn}}{n_{AgNO_3}}=\dfrac{0,01}{1}:\dfrac{0,01}{2}=2:1\rightarrow Zndư\)
Theo pt: \(n_{Zn}pư=\dfrac{1}{2}.nAgNO_3=0,005\left(mol\right)\)
=> \(m_{Zn}Pư=0,005.65=0,325g\)
b) m = 0,5 - 0,325 = 0,175g
b) Giả sử lượng Ag sinh ra bám vào thanh kẽm
Theo PTHH: \(n_{Ag}=n_{AgNO_3}=0,01\left(mol\right)\) \(\Rightarrow m_{Ag}=0,01\cdot108=1,08\left(g\right)\)
\(\Rightarrow m_{thanhkẽm}=m_{Zn}-m_{Zn\left(p/ứ\right)}+m_{Ag}=1,405\left(g\right)\)