bai 1 :cho 26g kẽm tác dụng với dung dịch có chứa 18,25g axit clohydric
a) viết phương trình hóa học
b) sau phản ứng chất nào còn dư , dư bao nhiêu gam?
bài 2 : Trong phòng thí nghiệm có các kim loại nhôm, sắt và dung dịch HCl. Neu cho cùng 1 khối lượng các kim loại trên tác dụng với dung dịch HCl thì kim loại nào cho khí hydro nhiều hơn ?
mn giúp e vs ạ , e cảm ơn


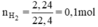


\(n_{Zn}=\dfrac{26}{65}=0,4\left(mol\right)\)
\(n_{HCl}=\dfrac{18,25}{36,5}=0,5\left(mol\right)\)
PTHH :
a, \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
Trc p/u : 0,4 0,5
p/u: 0,25 0,5 0,25 0,25
sau p/u : 0,15 0 0,25 0,25
b, ----> sau p/ư ; Zn dư
\(m_{Zndư}=0,15.65=9,75\left(g\right)\)
PTHH :
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
Từ PTHH ta có , 1 mol Al sẽ cho ra 1,5 mol H2
1 mol Fe sẽ cho ra 1 mol H2
Mà Al lại có Khối lượng mol nhỏ hơn Fe
Vậy , nếu cho cùng 1 khối lượng 2 kim loại trên thì Al sẽ cho ra nhiều H2 hơn