Cho 12 gam hỗn hợp hai kim loại Fe, Cu tác dụng vừa đủ với dung dịch HNO3 63%. Sau phản ứng thu được dung dịch A và 11,2 lít khí NO2 duy nhất (đktc). Tính nồng độ phần trăm của các chất có trong dung dịch A.
A. 36,66% và 28,48%.
B. 27,19% và 21,12%.
C. 27,19% và 72,81%.
D. 78,88% và 21,12%.


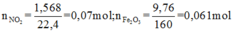
Ta có thể viết 2 phản ứng:
Fe+6HNO3 ⇒ Fe(NO3)3 +3NO2 +3H2O
Cu+4HNO3 ⇒ Cu(NO3)2 +2NO2 +2H2O
Có
Quan sát các phản ứng nhận thấy:
Dung dịch A thu được chứa Fe(NO3)3 và Cu(NO3)2.
Áp dụng định luật bảo toàn khối lượng ta có:
Đáp án B.