Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

+ Tính được những gì có thể tính được
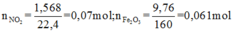
+ Với bài toán gồm nhiều giai đoạn liên tiếp nhau như thế này ta nên tóm tắt lại bài toán:
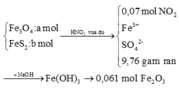
Bây giờ ta phải thiết lập được mối quan hệ giữa a và b với hi vọng là tìm được a và b rồi sau đó áp dụng các định luật bảo toàn như khối lượng, nguyên tố, electron ....
+ Bảo toàn nguyên tố Fe: 3a + b = nFe = 2.0,061 = 0,122
+ Bảo toàn sốmol electron trao đổi: a + 15b = 0,07.1 ( Chú ý FeS2→Fe3+ + 2S+6 + 15e)
Giải được a = 0,04; b = 0,002.
+ Tiếp tục sử dụng bảo toàn nguyên tố S:
![]()
+ Vì phản ứng xảy ra hoàn toàn và vừa đủ nên sau khi phản ứng với dung dịch NaOH ta chỉ thu được 2 muối là Na2SO4 và NaNO3.
Áp dụng định luật bảo toàn nguyên tố Na:
![]()
+ Cuối cùng dựa vào sơ đồ tóm tắt, ta sẽ dùng bảo toàn nguyên tố N
![]()
=>![]()
Đáp án D

Đáp án D.
Do sau phản ứng còn hai kim loại là Cu và Fe → trong dung dịch X chỉ có Fe(NO3)2

Đáp án A
Do Fe dư nên chỉ tạo ra Fe2+.
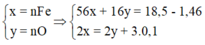
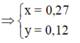
4H+ + NO3- + 3e → NO + 2H2O
2H+ + O + 2e → H2O
=> nHNO3 = nH+ = 4nNO + 2nO = 4.0,1 + 2.0,12 = 0,64
=> [HNO3] = 0,64/0,2 = 3,2M => Chọn A.

Xét phần 1: do sinh ra H2 ⇒ Al dư. nH2 = 0,075 mol ⇒ nAl dư = 0,05 mol.
Rắn không tan là Fe. Ta có: 2H2SO4 + 2e → SO2 + SO42– + 2H2O.
⇒ nSO42– = nSO2 = 0,6 mol ⇒ nFe = (82,8 – 0,6 × 96) ÷ 56 = 0,45 mol.
8Al + 3Fe3O4 → 4Al2O3 + 9Fe ⇒ nAl2O3 = 0,45 × 4 ÷ 9 = 0,2 mol.
⇒ mphần 1 = 0,05 × 27 + 0,2 × 102 + 0,45 × 56 = 46,95(g) ⇒ m phần 2 = 187,8(g).
⇒ phần 2 gấp 4 lần phần 1 ⇒ phần 2 chứa 0,2 mol Al; 0,8 mol Al2O3; 1,8 mol Fe.
Ta có: nH+ = 4nNO + 2nNO2 + 2nO + 10nNH4+ ⇒ nNH4+ = 0,015 mol.
Đặt nFe(NO3)2 = b ⇒ a + b = nFe = 1,8 mol; Bảo toàn electron:
0,2 × 3 + 3a + 2b = 1,25 × 3 + 1,51 + 0,015 × 8. Giải hệ có: a = 1,18.
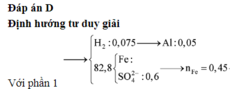
Đáp án D

Đáp án A
![]()
Đặt số mol của FeO và Fe trong A lần lượt là x, y
=> 72x+56y=24,04-180.0,07=11,44
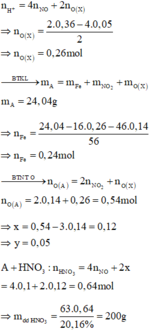
Có
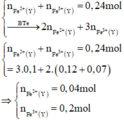
⇒ C % Fe NO 3 3 = 242 . 0 , 2 200 + 24 , 4 - 30 . 0 , 1 . 100 % = 21 , 9 %
Gần nhất với giá trị 22%

Giải thích:
Phần 1:
nH2 = 0,075 => nAldư = 0,05
8Al + 3Fe3O4 → 4Al2O3 + 9Fe
8x→ 3x →4x → 9x
Chất rắn không tan trong NaOH là Fe (9x mol). Với H2SO4 đặc nóng
=> Fe3+ (u) và Fe2+ (v)
Bảo toàn electron: 3u + 2v = 0,6 . 2
m muối = 400a/2 + 152b = 82,8
=> u = 0,3 và v = 0,15
=> 9x = u + v => x = 0,05
Vậy phần 1 chứa Al (0,05), Al2O3 (0,2) và Fe (0,45)
=> mPhần 1 = 46,95
=> mPhần 2 = mX - mPhần 1 = 187,8
=> mPhần 2 = 4mPhần 1
Vậy phần 2 chứa các chất có số mol gấp 4 phần 1.
Phần 2 chứa Al (0,2), Al2O3 (0,8) và Fe (1,8)
=> nO = 0,8 . 3 = 2,4
nH+ = 12,97 = 4nNO + 2nNO2 + 2nO + 10nNH4+
=> nNH4+ = 0,015
Dung dịch A chứa Fe3+ (a mol), Fe2+ (y mol) và các ion khác.
Bảo toàn Fe => a + b = 1,8
Bảo toàn electron => 3a + 2b + 0,2 . 3 = 1,25 . 3 + 1,51 + 0,015 . 8
=> a = 1,18 và b = 0,62
Đáp án D
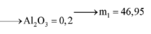
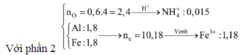
Ta có thể viết 2 phản ứng:
Fe+6HNO3 ⇒ Fe(NO3)3 +3NO2 +3H2O
Cu+4HNO3 ⇒ Cu(NO3)2 +2NO2 +2H2O
Có
Quan sát các phản ứng nhận thấy:
Dung dịch A thu được chứa Fe(NO3)3 và Cu(NO3)2.
Áp dụng định luật bảo toàn khối lượng ta có:
Đáp án B.