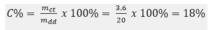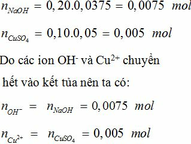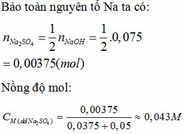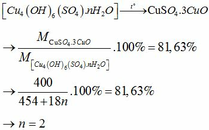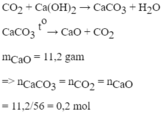Đun nhẹ 20g dung dịch CuSO4 cho đến khi nước bay hơi hết, người ta thu được chất rắn màu trắng là CuSO4 khan. Chất này có khối lượng là 3,6g. Hãy xác định nồng độ phần trăm của dung dịch CuSO4.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

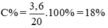

Nồng độ phần trăm của dung dịch:
C% = . 100% =
. 100% = 18%
nồng độ % của dung dịch \(CuSO_4\) là
\(\frac{3,6}{20}.100\%=18\%\)

Nồng độ phần trăm của dung dịch:
C% = . 100% =
. 100% = 18%
nồng độ % của dung dịch \(CuSO_4\) là
\(\frac{3,6}{20}.100\%=18\%\)

Khối lượng dung dịch C u S O 4 ban đầu:
m d d = V.D = 165,84.1,206=200(g)
Nồng độ % của dung dịch C u S O 4 :
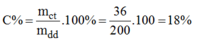

1)
\(m_{ddCuSO_4\left(bd\right)}=1,6.25=40\left(g\right)\)
\(n_{CuSO_4.5H_2O}=\dfrac{11,25}{250}=0,045\left(mol\right)\)
=> \(n_{CuSO_4}=0,045\left(mol\right)\)
\(C_M=\dfrac{0,045}{0,025}=1,8M\)
\(C\%=\dfrac{0,045.160}{40}.100\%=18\%\)
b)
\(m_{CuSO_4}=\dfrac{200.18}{100}=36\left(g\right)\)
\(n_{CuSO_4.5H_2O}=\dfrac{5,634}{250}=0,022536\left(mol\right)\)
nCuSO4 (tách ra) = 0,022536 (mol)
=> \(m_{CuSO_4\left(dd.ở.t^o\right)}=36-0,022536.160=32,39424\left(g\right)\)
\(m_{H_2O\left(bd\right)}=200-36=164\left(g\right)\)
nH2O (tách ra) = 0,022536.5 = 0,11268 (mol)
=> \(m_{H_2O\left(dd.ở.t^o\right)}=164-0,11268.18=161,97176\left(g\right)\)
\(S_{t^oC}=\dfrac{32,39424}{161,97176}.100=20\left(g\right)\)

Đặt a,b là số mol CuSO4 và CuSO4.5H2O
_> 160a + 250b = 16,5
Sau pha trộn mdd= 183,5+16,5= 200 gam
_> nCuSO4 tổng= a +b=200.6%/160
_> a= 0,025 và b = 0,05
mCuSO4= 160a=4gam
mCuSO4.5H2O = 250b = 12,5 gam