Cho một mẩu Na vào 200ml dd AlCl3 thu được 2,8 lít khí (đktc) và kết tủa. Lọc và nung A đến khối lượng ko đổi thu được 2,55g chất rắn. Tính \(C_M\) của dd AlCl3
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án : D
nAl2O3 = 0,05 mol => nAl(OH)3 = 0,1 mol
, nH2 = 0,25 mol
,nNa = nNaOH = 2nH2 = 0,5 mol
=> Kết tủa bị tan 1 phần => nAl(OH)3 = 4nAl3+ - nOH-
=> x = 1,5(M)

\(\begin{array}{l} a,\\ PTHH:\\ AlCl_3+3KOH\to Al(OH)_3\downarrow+3KCl\ (1)\\ 2Al(OH)_3\xrightarrow{t^o} Al_2O_3+3H_2O\ (2)\\ b,\\ n_{KOH}=\dfrac{3,36}{56}=0,06\ (mol)\\ Theo\ pt\ (1):\ n_{AlCl_3}=\dfrac{1}{3}n_{KOH}=0,02\ (mol)\\ \Rightarrow m_{AlCl_3}=0,02\times 133,5=2,67\ (g)\\ c,\\ Theo\ pt\ (1):\ n_{Al(OH)_3}=\dfrac{1}{3}n_{KOH}=0,02\ (mol)\\ Theo\ pt\ (2):\ n_{Al_2O_3}=\dfrac{1}{2}n_{Al(OH)_3}=0,01\ (mol)\\ \Rightarrow m_{Al_2O_3}=0,01\times 102=1,02\ (g)\end{array}\)

Đáp án D
m gam K (x mol) + 0,25a mol AlCl3 → 0,25 mol H2↑ + ↓. Nung ↓ → 0,05 mol Al2O3
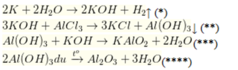
Theo (*) nH2 = 1/2x = 0,25 → nK = 0,5 mol.
Theo (**) nKOH = 3 × nAlCl3 = 3 × 0,25a = 0,75a mol;
nAl(OH)3 = 0,25a mol.
Theo (***) nAl(OH)3 dư = 0,05 × 2 = 0,1 mol
→ nAl(OH)3 phản ứng = 0,25a - 0,1
→ nKOH = 0,25a - 0,1
→ ∑nKOH = 0,75a + 0,25a - 0,1 = 0,5 → a = 0,6

2Na+2H2O--->2NaOH+H2
3NaOH+AlCl3--->Al(OH)3+3NaCl
2Al(OH)3--->Al2O3+3H2
n\(_{AL2O3}=\frac{2,55}{102}=0,025\left(mol\right)\)
n\(_{H2}=\frac{2,8}{22,4}=0,125\left(mol\right)\)
Theo pthh3
n\(_{Al2O3}=\frac{1}{2}n_{Al\left(OH\right)3}=0,0125\left(mol\right)\)
Theo pthh2
n\(_{AlCl3}=n_{Al\left(OH\right)3}=0,0125\left(mol\right)\)
Theo pthh1
n\(_{NaOH}=2n_{H2}=0,25\left(mol\right)\)
=> Ở pth2 số molNaOH dư
Theo pthh2
C\(_{M\left(AlCl3\right)}=\frac{0,0125}{0,2}=0,0625\left(M\right)\)
\(PTHH:Na+H2O\rightarrow NaOH+\frac{1}{2}H2\)
nH2 =nKhi =0,125 --> 2.nH2= nNa=0,25 mol----> nOH-=0,25 mol
\(\text{nAl2O3 = nCR=0,025 mol }\)
\(\Rightarrow\text{ nAl(OH)3 =2. nAl2O3=0,05 mol}\)
nOH- = 3. n Al(OH)3 + 4. Al(OH)4----> nAl(OH)4-=0,025 mol
\(\text{n AlCL3 = n Al(OH)3 + nAl(OH)4-=0,075 mol}\)
\(\Rightarrow\text{CM của AlCl3=0,375M}\)