bài 1:Cho m gam bột Al td vs O2 thu đc 12,9g hỗn hợp rắn X.Cho td vs lượng dư HCl thu đc 3,36l khí O2 ở đktc
a,Viết các PTHH
b, tính giá trị của m
c,Tính khối lượng oxi à HCl phản ứng
bài 2:Hỗn hợp X đốt cháy hoàn toàn 3,6g kim loại M trg bình chứa O2 thu đc 6g oxit A hoà tan hoàn toàn A trg dd HCl vừa đủ thu đc m gam muối
a, Xác định kim loại M
b,tính m
bài 3:cho 8,4g Fe tác dụng hết vs O2thu đc m gam oxit sắt từ
a,tính m
b cho 0,5m gam Fe2O3 tác dụng vs H2SO4 loãng .Tính khối lượng muối thu đc sau phản ứng
bài 4:đốt cháy 5g hỗn hợp C và S trg bình chứa O2 dư thu đc 13g hỗn hợp sản phẩm của CO2và SO2.Tính VO2 ở đktc đã phản ứng
bài 5:để đốt cháy hoàn toàn 6,72 lít hỗn hợp khí X gồm CO và H2 cần dùng v lít oxi vừa đủ
a,viết PTHH
b,tính v
bài 6:đốt 22,8g hỗn hợp CuS và FeS trg khí oxi dư thu đc m gam hỗn hợp chất rắn gồm Fe2O3 và CuO và 5,6 lít SO2 ở đktc
a,viết các PTHH
b, tính thành phần % khối lượng mỗi oxit trg hỗn hợp rắn
bài 7: đốt cháy hoàn toàn m gam rượu etylic=v lít khí oxi ở đktc (vừa đủ thu đc CO2 và 5,4g nước)
a,viết các PTHH xảy ra
b,tính m và v

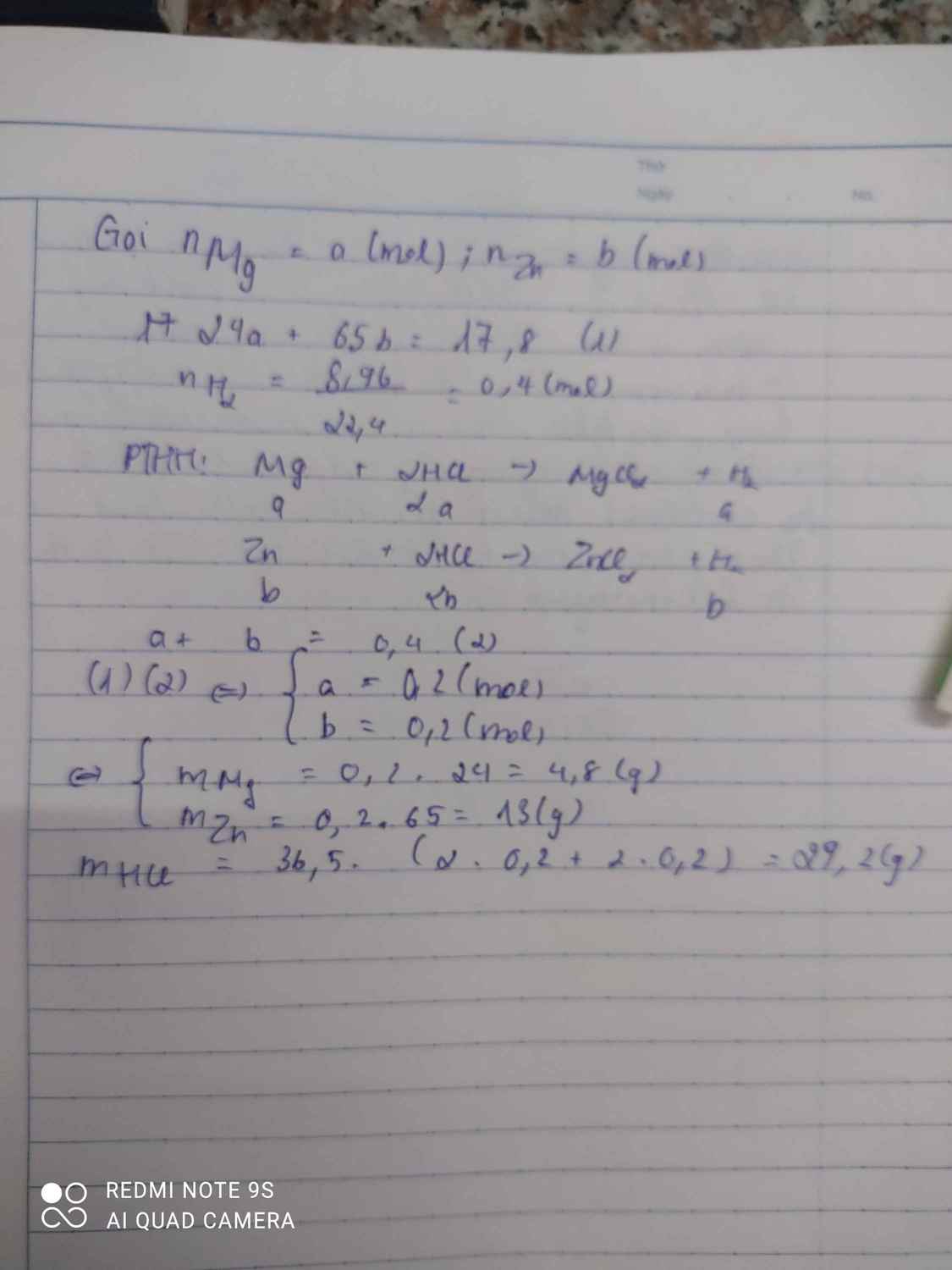
Bài1
Vì chất rắn thu được sau phản ứng đem tác dụng vs dd HCl cho ra H2 nên chất rắn gồm Al2O3 và Al dư.
số mol hiđrô là; nH2 = 3,36 / 22,4 = 0,15(mol)
PTHH;
4Al + 3O2 = 2Al2O3
Al2O3 + 6HCl = 2AlCl3 + 3H2O
2Al + 6HCl = 2AlCl3 + 3H2
0,1-----------------------------0,15
mAl dư =0,1.27=2,7(g)
m Al2O3=12,9-2,7=10,2(g)
nAl2O3=0,1(mol)
m\(_{Al}=2,7\left(g\right)\)
m=2,7+2,7=5,4(g)
Bài 3 cho 8,4g Fe tác dụng hết vs O2thu đc m gam oxit sắt từ
a,tính m
b cho 0,5m gam Fe2O3 tác dụng vs H2SO4 loãng .Tính khối lượng muối thu đc sau phản ứng
a) 3Fe+2O2---->Fe3O4
n\(_{Fe}=\frac{8,4}{56}=0,15\left(mol\right)\)
Theo pthh
n\(_{Fe3O4}=\frac{1}{3}n_{Fe}=0,05\left(mol\right)\)
m\(_{Fe3O4}=0,05.232=11,6\left(g\right)\)
b)Fe2O3+3H2SO4---->Fe2(SO4)3+3H2O
m Fe2O3=0,5.11,6=5,8(g)
n\(_{Fe2O3}=\frac{5,8}{160}=0,036\left(mol\right)\)
Theo pthh
n\(_{Fe2\left(SO4\right)3}=n_{Fe2O3}=0,036\left(mol\right)\)
m\(_{Fe2\left(SO4\right)3}=0,036.400=14,4\left(g\right)\)