Hỗn hợp gồm Fe2O3 và CuO tác dụng với H2O nhiệt độ cao thì được 26,4g hỗn hợp gồm Fe và Cu trong đó khối lượng Cu gấp 1,2 lần khối lượng Fe
Hãy tính
A khối lượng mỗi oxit trong hỗn hợp ban đầu
B tính VH2
C cho toàn bộ khối lươngj Fe ở trên tác dụng với H2SO4 chứa 29,4g thì thu được bao nhiêu gam muối sắt

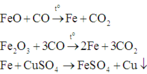
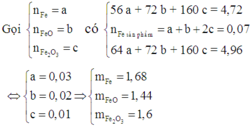
Fe2O3 + 3H2 => (to) 2Fe + 3H2O
CuO + H2 => (to) Cu + H2O
Gọi x,y lần lượt là khối lượng của Fe2O3 và CuO
Ta có: x + y = 26.4, y = 1.2x
==> x =12 ; y =14.4
nFe2O3 = m/M = 12/160 = 0.075 (mol)
nCuO = m/M = 14.4/80 = 0.18 (mol)
==> nH2 = 0.075x3 + 0.18 = 0.405 (mol)
==> VH2 = 22.4 x n = 0.405x 22.4 = 9.072 (l)
Fe + H2SO4 => FeSO4 + H2
nFe = 0.075x2 = 0.15 (mol)
nH2SO4 = m/M = 29.4/98 = 0.3 (mol)
Lập tỉ số: 0.15/1 < 0.3/1 => H2SO4 dư
nFeSO4 = 0.15 (mol) => mFeSO4 = n.M = 152x0.15 = 22.8 (g)