Câu1:
a) Viết PTHH khi đốt cháy khí metan trong không khí
b) Để có hỗn hợp nổ mạnh nhất giữa khí metan và khí oxi thì phải trộn chúng theo tỉ lệ thể tích phù hợp nhất là bao nhiêu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Phát biểu đúng: b). Vậy số phát biểu đúng là 1
Các phát biểu sai là:
a) Metan cháy với oxi tạo hơi nước và khí lưu huỳnh đioxit => Sai vì tạo khí cacbonic ( C O 2 ) chứ không phải là lưu huỳnh đioxit
c) Trong phản ứng hóa học giữa Metan và Clo, chỉ có duy nhất một nguyên tử Hiđro của Metan có thể được thay thế bởi nguyên tử Clo => Sai.
d) Hỗn hợp gồm hai thể tích Metan và một thể tích Oxi là hỗn hợp nổ mạnh => Sai, hỗn hợp nổ gồm một thể tích Metan và hai phần thể tích Oxi
Đáp án: A

a) Theo phương trình hóa học, ta thấy nếu đốt cháy hết 1 mol phân tử khí CH4 thì phải cần 2 mol phân tử khí O2. Do đó thể tích khí oxi cần dùng để đốt cháy hoàn toàn 2 lít khí metan là:
VO2 = 2 . 2 = 4 lít.
b) Theo phương trình phản ứng, khi đốt cháy hoàn toàn 0,15 mol khí metan thì cũng sinh ra 0,15 mol khí cacbon đioxit. Do đó thể tích khí CO2 thu được là:
VCO2 = 0,15 . 22,4 = 3,36 lít.
c) Tỉ khối của khí metan và không khí là:
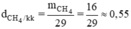
Vậy khí metan nhẹ hơn không khí 0,55.


a) Gọi số mol H2, CH4 là a, b
=> \(a+b=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
\(M_X=\dfrac{2a+16b}{a+b}=0,325.32=10,4\)
=> a = 0,2 ; b = 0,3
=> \(\left\{{}\begin{matrix}\%V_{H_2}=\dfrac{0,2}{0,5}.100\%=40\%\\\%V_{CH_4}=\dfrac{0,3}{0,5}.100\%=60\%\end{matrix}\right.\)
b) \(n_{O_2}=\dfrac{32}{32}=1\left(mol\right)\)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
0,3--->0,6------->0,3
2H2 + O2 --to--> 2H2O
0,2-->0,1
=> \(\left\{{}\begin{matrix}V_{CO_2}=0,3.22,4=6,72\left(l\right)\\V_{O_2\left(dư\right)}=\left(1-0,6-0,1\right).22,4=6,72\left(l\right)\end{matrix}\right.\)

Gọi số mol CH4, O2 là a, b (mol)
Có: \(\overline{M}_A=\dfrac{16a+32b}{a+b}=14,4.2=28,8\left(g/mol\right)\)
=> 12,8a = 3,2b
=> a : b = 1 : 4
Giả sử A gồm 1 mol CH4 và 4 mol O2
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
Xét tỉ lệ: \(\dfrac{1}{1}< \dfrac{4}{2}\) => CH4 hết, O2 dư
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
1---->2----------->1
=> \(B\left\{{}\begin{matrix}CO_2:1\left(mol\right)\\O_{2\left(dư\right)}=4-2=2\left(mol\right)\end{matrix}\right.\)
=> \(\overline{M}_B=\dfrac{1.44+2.32}{1+2}=36\left(g/mol\right)\)
=> \(d_{B/A}=\dfrac{36}{28,8}=1,25\)
a/ CH4 + 2O2 => CO2 + 2H2O
b/ Để có hỗn hợp nổ mạnh nhất giữa metan và oxi phải trộn theo tỉ lệ thể tích 1:2
Thank~