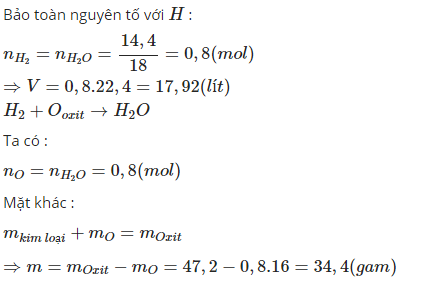3/ Dùng V lít khí H2 (đktc) để khử hoàn toàn 62,4 gam hỗn hợp gồm: CuO và Fe3O4 theo phản ứng:
CuO + H2 --to-> Cu + H2O
Fe3O4 + H2 --to-> Fe + H2O
sau phản ứng thu được 12,8 gam Cu và a gam Fe
a. Cân bằng phản ứng? tính a gam Fe?
b. Tính V lít khí H2 dùng cho cả 2 phản ứng trên?