Cho 1,02 gam hỗn hợp gồm Al và Mg vào 100ml dung dịch HCl. Sau khi kết thúc phản ứng, làm bay hơi hết nước thu được 3,86 gam chất rắn khan. Nếu cho 1,02 gam hỗn hợp trên vào 200ml dd HCL cùng loại. Sau khi kết thúc phản ứng, làm bay hơi hết nước thu được 4,57 gam chất rắn khan. Tính khối lượng kim loại trong hỗn hợp và nồng độ mol/l của dd HCl
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A.
Vì phản ứng giữa Al và AgNO3 xảy ra trước nên kim loại sau phản ứng phải có Ag, kế đến là CuSO4 có phản ứng tạo thành Cu. Theo giả thiết, có ba kim loại → kim loại thứ ba là Fe còn dư.
Ta có: nFe = 2,8/5,6 = 0,05 (mol)
nAl = 0,81/27 = 0,03 (mol)
và = 0,672/22,4 = 0,03 (mol)
Phản ứng: Fedư + 2HCl → FeCl2 + H2
(mol) 0,03 0,03
→ Số mol Fe phản ứng với muối: 0,05 – 0,03 = 0,02 (mol)
2Al + 3Cu2+ → 2Al3+ + 3Cu
Fe + 2Ag+ → Fe2+ + 2Ag
Fe + Cu2+ → Fe2+ + Cu
Ta có sự trao đổi electron như sau:
Al → Al3+ + 3e Fe → Fe2+ + 2e
0,03 0,09 (mol) 0,02 0,04 (mol)
Ag+ + 1e → Ag Cu2+ + 2e → Cu
x x x (mol) y 2y y (mol)
→ x + 2y = 0,09 + 0,04 = 0,13 (1) ; 108x + 64y + 56.0,03 = 8,12 (2)
Giải hệ phương trình (1) và (2), ta được x = 0,03; y = 0,05.
Vậy:


PTHH: \(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a) Ta có: \(\left\{{}\begin{matrix}n_{HCl}=\dfrac{12,7}{36,5}=\dfrac{127}{365}\left(mol\right)\\n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\end{matrix}\right.\)
Ta thấy: \(2n_{H_2}< n_{HCl}\) \(\Rightarrow\) Axit còn dư
b) Theo PTHH: \(n_{HCl\left(p/ứ\right)}=2n_{H_2}=0,3\left(mol\right)\) \(\Rightarrow m_{HCl}=0,3\cdot36,5=10,95\left(g\right)\)
Mặt khác: \(m_{H_2}=0,15\cdot2=0,3\left(g\right)\)
Bảo toàn khối lượng: \(m_{muối}=m_{KL}+m_{HCl\left(p/ứ\right)}-m_{H_2}=18,65\left(g\right)\)
c) PTHH: \(Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
Khi 8 gam kim loại p/ứ với HCl dư tạo 0,15 mol H2
\(\Rightarrow\) 8 gam kim loại p/ứ với H2SO4 dư cũng tạo 0,15 mol H2
\(\Rightarrow n_{H_2}=n_{H_2SO_4\left(p/ứ\right)}=0,15\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4\left(p/ứ\right)}=0,15\cdot98=14,7\left(g\right)\)

Đáp án C
Vì khi thêm HCl thì khối lượng chất rắn khan thu được tăng lên nên ở lần 1 kim loại phản ứng dư và HCl hết, lần 1 có
![]() nếu ở lần 2 kim loại vẫn dư và HCl hết thì tổng số mol HCl 2 lần là 0,36 + 0,24 = 0,6
nếu ở lần 2 kim loại vẫn dư và HCl hết thì tổng số mol HCl 2 lần là 0,36 + 0,24 = 0,6
Mà 2 lần có ![]()
nên lần 2 kim loại đã phản ứng hết.

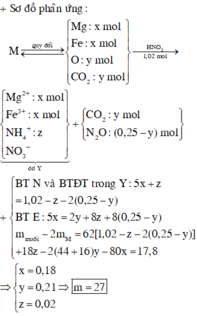
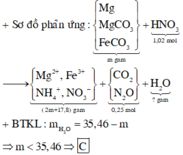

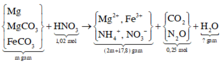
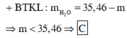
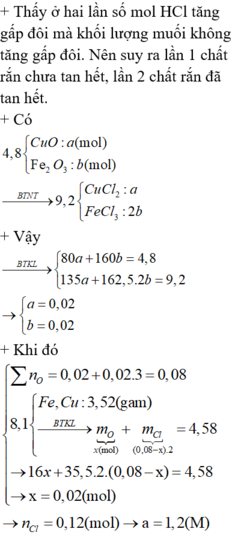
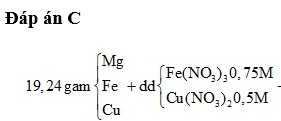


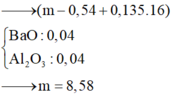
Khi lượng HCl gấp đôi thì lượng chất rắn thu đc không gấp đôi thí nghiệm 1 nên suy ra trong 2 trường hợp kim loại tan hết và HCl dư.
2 trường hợp->trường hợp 2
Gọi số mol của Mg và Al trong hh là x và y, ta có:
=> \(\left\{{}\begin{matrix}\text{24x+27y=1,02 }\\\text{95x+133.5y=4,57}\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}x=0,02\\y=0,02\end{matrix}\right.\)
=>\(\left\{{}\begin{matrix}m_{Mg}=0,02.24=0,48g\\m_{Al}=0,02.27=0,54g\end{matrix}\right.\)
Tính nồng độ mol/1 của dung dịch HCl
- Xét TN1: gọi số mol Al đã pứ là a còn dư là 0,02.-a (Mg đã pư hết)
Khối lg chất rắn = 0,02.95+133,5a+27(0,02.-a)=3,86 => a=0,0133
Số mol HCl hòa tan Mg và Al là (0,02.2)+3.0,133=0,08 mol
Nồng độ mol/1 của HCl là 0,08/0,1=0,8 M