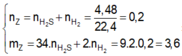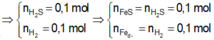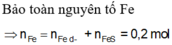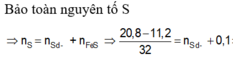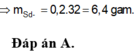nung hỗn hợp A gồm bột sắt và lưu huỳnh không có oxi sau một thời gian thu được hỗn hợp chất rắn b. cho b tác dụng với dd hcl dư thu được V1 lít hỗn hợp khí C. tỷ khối của C so với h2 bằng 10,6. nếu đốt cháy hoàn toàn B thành fe2o3 và so2 cần V2 lít khí o2. viết các phương trình hóa học và tìm tương quan giá trị V1 và V2 ( V1 và V2 đo ở cùng đk nhiệt độ và áp suất )
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

ĐÁP ÁN A
Hỗn hợp khí gồm H2 và H2S với số mol lần lượt là x và y
Chất rắn là S
=> x + y = 0,2 mol và 2x + 34y = 3,6g
=> x = y = 0,1 mol
Fe + S -> FeS
Bảo toàn e : nFe bđ = nFe dư + nFeS = 0,2 mol
=> nS (bđ) = 0,3 mol
=> nS dư = 0,3 – 0,1 = 0,2 mol
=> m = 6,4g

PT: \(Fe+S\underrightarrow{t^o}FeS\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(FeS+H_2SO_4\rightarrow FeSO_4+H_2S\)
\(H_2S+Pb\left(NO_3\right)_2\rightarrow2HNO_3+PbS\)
Ta có: mS (chưa pư) = 1,6 (g)
Theo PT: \(n_{S\left(pư\right)}=n_{FeS}=n_{H_2S}=n_{PbS}=\dfrac{43,02}{239}=0,18\left(mol\right)\)
⇒ ΣmS = 1,6 + 0,18.32 = 7,36 (g) = b
Ta có: dB/H2 = 10,6
\(\Rightarrow\dfrac{2n_{H_2}+34n_{H_2S}}{n_{H_2}+n_{H_2S}}=10,6.2\Rightarrow\dfrac{2n_{H_2}+34.0,18}{n_{H_2}+0,18}=10,6.2\)
\(\Rightarrow n_{H_2}=0,12\left(mol\right)\)
Theo PT: nFe (chưa pư) = nH2 = 0,12 (mol)
nFe (pư) = nFeS = 0,18 (mol)
⇒ mFe = (0,12 + 0,18).56 = 16,8 (g) = a

Gọi x,y là số mol Fe phản ứng, Fe dư
Fe+S\(\rightarrow\)FeS
.x.....x.........x
FeS+2HCl−−−>FeCl2+H2S
.....x....................................x
Fe+2HCl−−−>FeCl2+H2
...y................................y
H2S+Pb(NO3)2−−−>PbS\(\downarrow\)+2HNO3
0,1..............................0,1........
Ta có: \(\dfrac{34x+2y}{x+y}\)=18
=> x=y=0,1
m\(_{Fe}\)bđ=m\(_{Fe}\) pứ + m\(_{Fe}\) dư =0,1.2.56=11,2(g)
m\(_S\)bđ=m\(_S\) pứ + m\(_S\) dư =0,1.32+0,8=4(g)

a/ PTHH: Fe + S ===> FeS
0,05...0,05.......0,05
FeS + 2HCl ===> FeCl2 + H2S
0,05........................................0,05
Fe + 2HCl ===> FeCl2 + H2
(0,075 - 0,05) ................................( 0,075 - 0,05) = 0,025 mol
nFe = 4,2 / 56 = 0,075 mol
nS = 1,6 / 32 = 0,05 mol
=> Fe dư, S hết
=> Chất rắn B là FeS, Fe
Hỗn hợp khí C là: H2S và H2
b/ Lập các sô mol của từng chất theo phương trình
Ta thấy: tỉ lệ về thể tích cũng là tỉ lệ về sô mol
=> %VH2S = \(\frac{0,05}{0,05+0,025}.100\%=66,67\%\)
=> %VH2 = 100% - 66,67% = 33,33%
nFe = 4.2/56=0.075(mol)
nS=1.6/32=0.05(mol)
............................. Fe + S ➞ FeS
Trước phản ứng :0.075 : 0.05 (mol)
Trong phản ứng :0.05 : 0.05 : 0.05 (mol)
Sau phản ứng :0.025 : 0 : 0.05 (mol)
Fe + 2 HCl ➞ FeCl2 + H2
0.025: :0.025 (mol).
FeS +2 HCl ➞ FeCl2 + H2S
0.05: : 0.05 (mol)
a) B là gồm (dư) , FeS
C gồm H2S , H2
b)do tỉ lệ thể tích bằng tỉ lệ số mol nên
%H2 = 0.025/(0.05+0.025)=33.333%
%H2S= 100% - 33.333% = 66.667%

a) mCu = 3,2 (g)
=> mFe = 6 - 3,2 = 2,8 (g)
\(n_{Fe}=\dfrac{2,8}{56}=0,05\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,05->0,1--->0,05--->0,05
=> V1 = 0,05.22,4 = 1,12 (l)
\(n_{Cu}=\dfrac{3,2}{64}=0,05\left(mol\right)\)
PTHH: 2Fe + 6H2SO4(đ/n) --> Fe2(SO4)3 + 3SO2 + 6H2O
0,05--------------------------------->0,075
Cu + 2H2SO4 --> CuSO4 + SO2 + 2H2O
0,05------------------------>0,05
=> V2 = (0,075 + 0,05).22,4 = 2,8 (l)
b)
nHCl(dư) = 0,5.2 - 0,1 = 0,9 (mol)
=> \(\left\{{}\begin{matrix}C_{M\left(HCl.dư\right)}=\dfrac{0,9}{0,5}=1,8M\\C_{M\left(FeCl_2\right)}=\dfrac{0,05}{0,5}=0,1M\end{matrix}\right.\)

\(Fe+S-t^0->FeS\\ n_{Fe}:n_S=\dfrac{11,2}{56}:\dfrac{4,8}{32}=0,2:0,15\Rightarrow Fe:dư\left(0,05mol\right)\\ Fe+2HCl->FeCl_2+H_2\\ FeS+2HCl->FeCl_2+H_2S\\ d_{\dfrac{B}{kk}}=\dfrac{\dfrac{0,05.2+0,15.34}{0,2}}{29}=0,89655\)