Cho 1,3g kẽm tác dụng vừa đủ với dd HCl 10%.
a.Tính thể tích khí thu được (đktc)
b.Tính khối lượng HCl cần dùng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

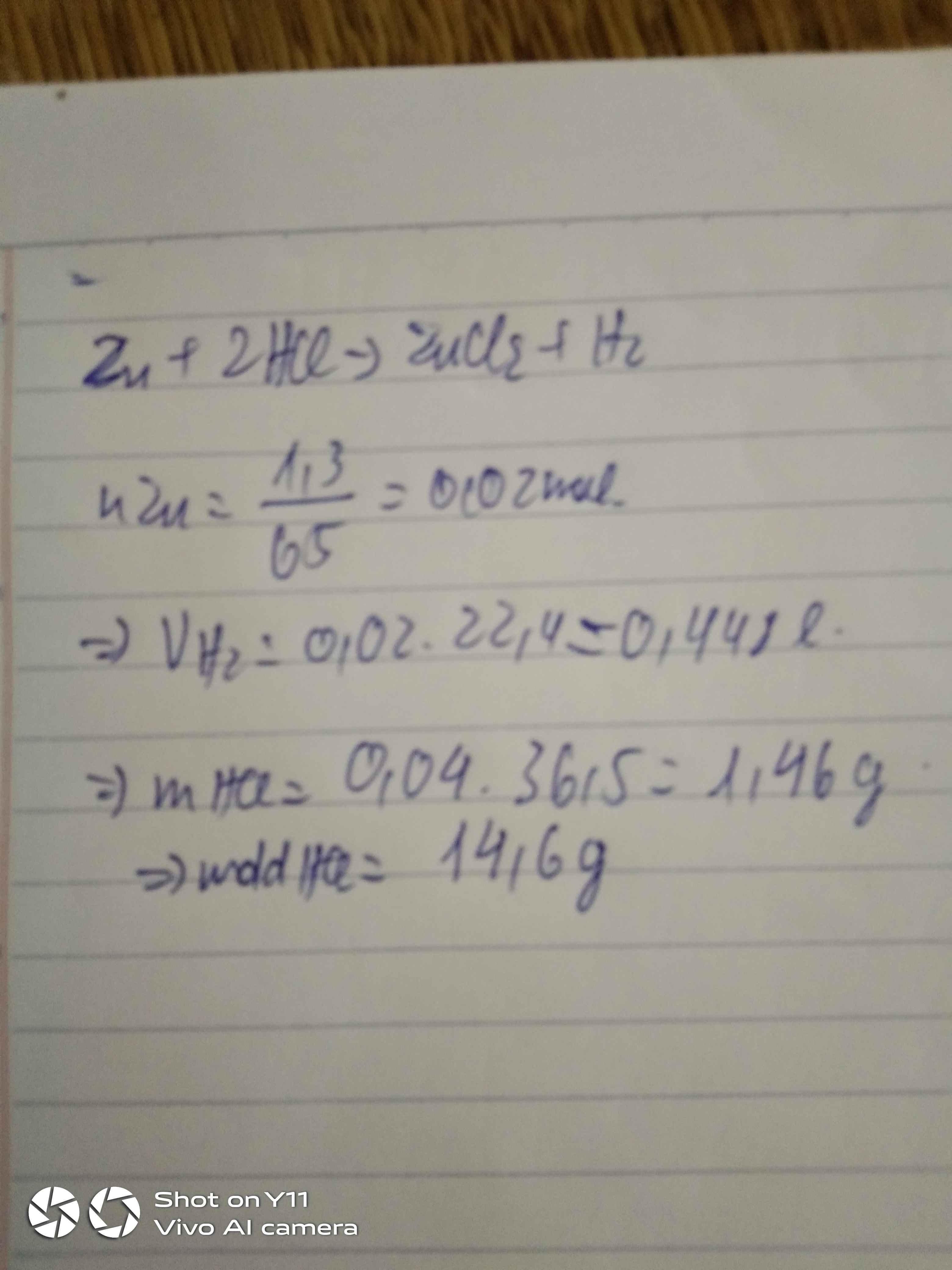

a. Zn (0,1 mol) + 2HCl \(\rightarrow\) ZnCl2 (0,1 mol) + H2 (0,1 mol).
Khối lượng kẽm clorua thu được là 0,1.136=13,6 (g).
b. Thể tích khí hiđro sinh ra ở đktc là 0,1.22,4=2,24 (lít).
\(n_{Zn}=\dfrac{6,5}{65}=0,1mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1 ( mol )
\(m_{HCl}=0,2.36,5=7,3g\)
\(V_{H_2}=0,1.22,4=2,24l\)

Bài 1 :
\(a) Fe_2O_3 + 3H_2 \xrightarrow{t^o}2Fe + 3H_2O\\ b) n_{Fe_2O_3} = \dfrac{80}{160}= 0,5(mol)\\ n_{H_2} = 3n_{Fe_2O_3} = 1,5(mol)\\ \Rightarrow V_{H_2} = 1,5.22,4 = 33,6(lít)\\ n_{Fe} = 2n_{Fe_2O_3} = 1(mol)\\ m_{Fe} = 1.56 = 56(gam)\)
Bài 2 :
\(a) Fe + 2HCl \to FeCl_2 + H_2\\ n_{H_2} = n_{Fe} =\dfrac{5,6}{56} = 0,1(mol)\\ V_{H_2} = 0,1.22,4 = 2,24(lít)\\ n_{HCl} =2 n_{Fe} = 0,2(mol)\\ m_{HCl} = 0,2.36,5 = 7,3(gam)\)

`Zn + 2HCl -> ZnCl_2 + H_2`
`0,01` `0,02` `0,01` `0,01` `(mol)`
`n_[Zn]=[0,65]/65=0,01(mol)`
`a)V_[H_2]=0,01.22,4=0,224(l)`
`b)m_[ZnCl_2]]=0,01.136=1,36(g)`
`c)V_[HCl]=[0,02]/2=0,01(l)`
\(n_{Zn}=\dfrac{0,65}{65}=0,01\left(mol\right)\\
pthh:Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
0,01 0,02 0,01 0,01
\(V_{H_2}=0,01.22,4=0,224\left(l\right)\\
m_{ZnCl_2}=0,01.136=1,36\left(g\right)\\
V_{HCl}=\dfrac{0,02}{2}=0,01\left(l\right)\)

PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
Ta có: \(n_{Zn}=\dfrac{32,5}{65}=0,5\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{HCl}=1\left(mol\right)\\n_{H_2}=0,5\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{ddHCl}=\dfrac{1\cdot36,5}{20\%}=182,5\left(g\right)\\V_{H_2}=0,5\cdot22,4=11,2\left(l\right)\end{matrix}\right.\)

Câu 2:
\(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: \(2KMnO_4\xrightarrow[]{t^o}K_2MnO_4+MnO_2+O_2\)
0,6<------------------------------------0,3
\(\Rightarrow m_{KMnO_4}=0,6.158=94,8\left(g\right)\)
Câu 3:
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,2<-----------------------0,2
=> mZn = 0,2.65 = 13 (g)
Câu 4:
\(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\)
PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,4------------------------->0,4
\(CuO+H_2\xrightarrow[]{t^o}Cu+H_2O\)
0,4<---0,4
\(\Rightarrow m_{CuO}=0,4.80=32\left(g\right)\)

TTĐ:
\(m_{Zn}=6,5\left(g\right)\)
_______________
\(V_{H_2}=?\left(l\right)\)
\(m_{HCl}=?\left(g\right)\)
Giải
Số mol của 6,5 gam Zn:
\(n_{Zn}=\dfrac{m}{M}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
PTHH:
\(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
Tỉ lệ: 1 : 2 : 1 : 1
Số mol: 0,1-> 0,2 : 0,2 : 0,2(mol)
a/ thể tích khí hiđro thu được:
\(V_{H_2}=n.22,4=0,1.22,4=2,24\left(l\right)\)
b/ Khối lượng của 0,2 mol HCl:
\(m_{HCl}=n.M=0,2.36,5=7,3\left(g\right)\)

a) \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
______0,2-->0,6--------------->0,3
=> mHCl = 0,6.36,5 = 21,9 (g)
b) VH2 = 0,3.22,4 = 6,72 (l)
a)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
______0,2-->0,6--------------->0,3
=> mHCl = 0,6.36,5 = 21,9 (g)
b) VH2 = 0,3.22,4 = 6,72 (l)

Câu 1:
a, \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
b, \(n_{Zn}=\dfrac{16,25}{65}=0,25\left(mol\right)\)
\(n_{H_2}=n_{Zn}=0,25\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,25.24,79=6,1975\left(l\right)\)
c, \(n_{HCl}=2n_{Zn}=0,5\left(mol\right)\)
\(\Rightarrow m_{HCl}=0,5.36,5=18,25\left(g\right)\)
\(\Rightarrow m_{ddHCl}=\dfrac{18,25}{10\%}=182,5\left(g\right)\)
d, \(n_{ZnCl_2}=n_{Zn}=0,25\left(mol\right)\)
\(\Rightarrow C\%_{ZnCl_2}=\dfrac{0,25.136}{16,25+182,5-0,25.2}.100\%\approx17,15\%\)
Câu 2:
a, \(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
c, \(n_{NaOH}=\dfrac{40}{40}=1\left(mol\right)\)
Theo PT: \(n_{H_2SO_4}=\dfrac{1}{2}n_{NaOH}=0,5\left(mol\right)\)
\(\Rightarrow V_{H_2SO_4}=\dfrac{0,5}{2}=0,25\left(l\right)\)
d, \(n_{Na_2SO_4}=\dfrac{1}{2}n_{NaOH}=0,5\left(mol\right)\)
\(\Rightarrow C_{M_{Na_2SO_4}}=\dfrac{0,5}{0,25}=2\left(M\right)\)

a)
$n_{Mg} = \dfrac{0,48}{24} = 0,02(mol)$
$Mg + 2HCl \to MgCl_2 + H_2$
Theo PTHH : $n_{H_2} = n_{Mg} = 0,02(mol)$
$V_{H_2} = 0,02.22,4 = 0,448(lít)$
b)
$n_{HCl} = 2n_{H_2} = 0,04(mol)$
$m_{dd\ HCl} = \dfrac{0,04.36,5}{3,65\%} = 40(gam)$
c)
Sau phản ứng, $m_{dd} = 0,48 + 40 - 0,02.2 = 40,44(gam)$
$C\%_{MgCl_2} = \dfrac{0,02.95}{40,44}.100\% = 4,7\%$
Số mol của magie
nMg = \(\dfrac{m_{Mg}}{M_{Mg}}=\dfrac{0,48}{24}=0,02\left(mol\right)\)
Pt : Mg + 2HCl → MgCl2 + H2\(|\)
1 2 1 1
0,02 0,04 0,02
a) Số mol của khí hidro
nH2 = \(\dfrac{0,02.1}{1}=0,02\left(mol\right)\)
Thể tích của khí hidro ở dktc
VH2 = nH2 . 22,4
= 0,02 . 22,4
= 0,48 (l)
b) Số mol của axit clohidric
nHCl = \(\dfrac{0,02.2}{1}=0,04\left(mol\right)\)
Khối lượng của axit clohidric
mHCl = nHCl . MHCl
= 0,04 . 36,5
= 1,46 (g)
Khối lượng của dung dịch axit clohidric cần dùng
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{dd}=\dfrac{m_{ct}.100}{C}=\dfrac{1,46.100}{3,65}=40\) (g)