hòa tan 15,2 gam hỡn hợp feco3 và mg có tle kl mfeco3/mg=9/29 bằng dd h2so4 loãng dư đc hỗn h Y .tính ti khối hơi Y so H2 và mol h2so4 tgia p ứng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Bài 1:
PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)=n_{Fe}\)
\(\Rightarrow\%m_{Fe}=\dfrac{0,1\cdot56}{37,6}\cdot100\%\approx14,89\%\)
\(\Rightarrow\%m_{Fe_2O_3}=85,11\%\)
Bài 3:
PTHH: \(2HNO_3+Ba\left(OH\right)_2\rightarrow Ba\left(NO_3\right)_2+2H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{HNO_3}=0,05\cdot1=0,05\left(mol\right)\\n_{Ba\left(OH\right)_2}=\dfrac{342\cdot5\%}{171}=0,1\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,05}{2}< \dfrac{0,1}{1}\) \(\Rightarrow\) Axit p/ứ hết, Bazơ còn dư sau p/ứ
\(\Rightarrow\) Dung dịch sau p/ứ làm quỳ tím hóa xanh
Theo PTHH: \(n_{Ba\left(NO_3\right)_2}=\dfrac{1}{2}n_{HNO_3}=0,025\left(mol\right)\) \(\Rightarrow m_{Ba\left(NO_3\right)_2}=0,025\cdot261=6,525\left(g\right)\)

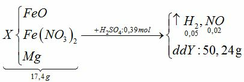
Vì Mg có tính khử rất mạnh nên trong Y có thể có muối (NH4)2SO4
BTNT N: 2nFe(NO3)2 = nNO + nNH4 => 2y = 0,02 + nNH4 => nNH4 = 2y – 0,02
BTNT H: 2nH2SO4 = 2nH2 + 4nNH4 + 2nH2O => 2 . 0,39 = 2 . 0,05 + 4 (2y – 0,02) + 2nH2O
=> nH2O = 0,38 – 4y
BTNT O: nFeO + 6nFe(NO3)2 = nNO + nH2O
=> x + 6y = 0,02 + 0,38 – 4y => x + 10y = 0,4
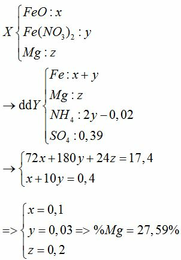

a, \(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
\(MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
b, \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Theo PT: \(n_{Mg}=n_{H_2}=0,1\left(mol\right)\Rightarrow m_{Mg}=0,1.24=2,4\left(g\right)\)
\(\Rightarrow m_{MgO}=4,4-2,4=2\left(g\right)\)
c, \(n_{MgO}=\dfrac{2}{40}=0,05\left(mol\right)\)
Theo PT: \(n_{H_2SO_4}=n_{Mg}+n_{MgO}=0,15\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4}=0,15.98=14,7\left(g\right)\)
\(\Rightarrow m_{ddH_2SO_4}=\dfrac{14,7}{19,6\%}=75\left(g\right)\)

Đáp án B
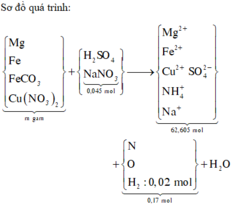
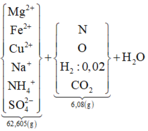
Bài toán phụ: NaOH xử lý dung dịch Y sau phản ứng. Tổng có (0,865 + 0,045 = 0,91mol) natri cuối cùng sẽ đi về đâu? À, là 0,455 mol Na2SO4 → có 0,455 mol gốc SO4, 0,455 mol axit H2SO4
Giả sử có x mol (NH4)2SO4 → còn (0,865 – 2x) mol OH sẽ tạo kết tủa hidroxit
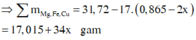
Vậy khối lượng muối Y là 62,605 = (17,015 + 34x) + 0,045.23 + 36x + 0,445.96 → x = 0,0125
Biết có 0,025mol NH4 → bảo toán nguyên tố H có 0,385 mol H2O
Lại có mZ = 0,17.19 : 17 . 32 = 6,08 gam nên bảo toàn khối lượng cả sơ đồ ta có:
M = 62,605 + 6,08 + 0,385.18 – 0,455.98 – 0,045.85 = 27,2 gam

Đáp án B
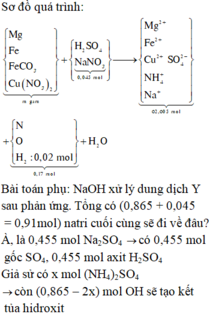
Z chứa H 2 => trong Y không chứa ion N O 3 - . Ta có sơ đồ phản ứng sau:
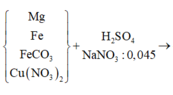
Bảo toàn nguyên tố Natri và gốc
S
O
4
: ![]()
Đặt
n
N
H
4
+
=
x
=> Bảo toàn gốc ![]()
![]()
![]()
![]()
![]()
Bảo toàn nguyên tố Hidro: n H 2 O = 0 , 385 m o l . Bảo toàn khối lượng:
![]()
![]()



mFeCO3= 9/38 x 15,2= 3,6(g) -> nFeCO3= 3,6/116= 14/29(mol)
=> mMg= 15,2- 3,6= 11,6(g) -> nMg=11,6/24= 29/60(mol)
PTHH: FeCO3 + H2SO4 -> FeSO4 + CO2 + H2O
14/29____________14/29_____________14/29(mol)
Mg + H2SO4 -> MgSO4 + H2
29/60____29/60____________29/60(mol)
Ta có:
\(M_Y=\dfrac{\dfrac{14}{29}.44+\dfrac{29}{60}.2}{\dfrac{14}{29}+\dfrac{29}{60}}=22,988\left(\dfrac{g}{mol}\right)\\ \rightarrow d_{\dfrac{Y}{H2}}=\dfrac{22,988}{2}=11,494\)
nH2SO4(p.ứ)=14/29 + 29/60=0,966(mol)
Gọi x,y lần lượt là số mol FeCO3 và Mg
Ta có : \(\left\{{}\begin{matrix}116x+24y=15,2\\\dfrac{116x}{24y}=\dfrac{9}{29}\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}x=\dfrac{9}{290}\\y=\dfrac{29}{60}\end{matrix}\right.\)
\(FeCO_3+H_2SO_4\rightarrow FeSO_4+CO_2+H_2O\)
\(\dfrac{9}{290}\)------>\(\dfrac{9}{290}\)--------------------->\(\dfrac{9}{290}\)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
\(\dfrac{29}{60}\)----->\(\dfrac{29}{60}\)-------------------->\(\dfrac{29}{60}\)
=> \(M_Y=\dfrac{\dfrac{9}{290}.44+\dfrac{29}{60}.2}{\dfrac{9}{290}+\dfrac{29}{60}}=4,53\)
=>dY/H2= \(\dfrac{4,53}{2}=2,265\)
\(n_{H_2SO_4}=\dfrac{9}{290}+\dfrac{29}{60}=\dfrac{179}{348}\left(mol\right)\)