giúp mình với các bạn hoc.24 ơi!1) cho 4g CuO tác dụng vùa đủ với dung dịch H2SO4 4,9% thu được muối CuSO4 và H20a, tính khối lượng dung dịch H2SO4 cần dùngb,tính C% dung dịch CuSO4 sau phản ứng tạo thành.2)Hòa tan 0,56g Fe vào dung dịch H2SO4loãng 19,6% phản ứng vừa đủa, tính thể tích H2sinh ra ở đktcb, tính C%dung dịch muối tạo thành.3)đốt cháy 10,1 g hỗn hợp Na và K cần dùng hết 1,68 lít O2 ở...
Đọc tiếp
giúp mình với các bạn hoc.24 ơi!
1) cho 4g CuO tác dụng vùa đủ với dung dịch H2SO4 4,9% thu được muối CuSO4 và H20
a, tính khối lượng dung dịch H2SO4 cần dùng
b,tính C% dung dịch CuSO4 sau phản ứng tạo thành.
2)Hòa tan 0,56g Fe vào dung dịch H2SO4loãng 19,6% phản ứng vừa đủ
a, tính thể tích H2sinh ra ở đktc
b, tính C%dung dịch muối tạo thành.
3)đốt cháy 10,1 g hỗn hợp Na và K cần dùng hết 1,68 lít O2 ở đktcthu được hỗn hợp chất rắn. Hòa tan hoàn toàn chất rằn thu được vào 200g H2O thu được dung dịch A
a, tính thành phần phần trăm về khối lượng trong hỗn hợp đầu
b tính C% các chất trong dung dịch A
mong các bạn nhiệt tình đưa ra các lời giải cho mình với , càng nhanh càng tốt ak
Cảm ơn các bạn rát nhiều.






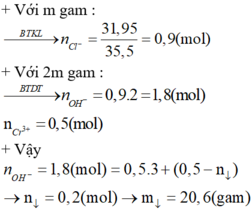
 Cho em hỏi tại sao nhân 2 mà không phải nhân 4 ạ ?
Cho em hỏi tại sao nhân 2 mà không phải nhân 4 ạ ?
\(n_{O_2}=\frac{1.68}{22.4}=0.075\left(mol\right)\)
\(4Na+O_2\rightarrow2Na_2O\)
x \(\frac{1}{4}x\) \(\frac{1}{2}x\)
\(4K+O_2\rightarrow2K_2O\)
x \(\frac{1}{4}x\) \(\frac{1}{2}x\)
Theo bài ra ta có \(\begin{cases}23x+39y=10.1\\\frac{1}{4}x+\frac{1}{4}y=0.075\end{cases}\) \(\begin{cases}0.1\\0.2\end{cases}\)
\(m_{Na}=0.1\times23=2.3\left(g\right)\)
\(m_K=0.2\times39=7.8\left(g\right)\)
\(\%m_{Na}=\frac{2.3}{10.1}\times100=22.7\%\)\(\%m_K=100\%-22.7\%=77.3\%\)thank you bạn nhiều nha Đạt Hoàng Minh!