1:Khí nào thu được khi cho hỗn hợp co,co2,cls,đi qua dung dịch NaOh.Viết phương trình phản ứng xảy ra
2:cho 60,6g Mno2 tác dụng dung dịch HCL đặc dư
a,cho tác dụng viết phương trình phản ứng
b,tính Hcl thu được ở DKTC
c,tính khối lượng dung dịch Hcl 36,5 % đã dùng

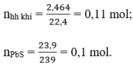
Câu 1: Bạn viết lại các khí !
Câu 2:
PTHH: \(MnO_2+4HCl\rightarrow MnCl_2+Cl_2\uparrow+2H_2O\)
Ta có: \(n_{MnO_2}=\dfrac{60,6}{87}=\dfrac{101}{145}\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}n_{HCl}=\dfrac{404}{145}\left(mol\right)\\n_{Cl_2}=\dfrac{101}{145}\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{ddHCl}=\dfrac{\dfrac{404}{145}\cdot36,5}{36,5\%}\approx278,6\left(g\right)\\V_{Cl_2}=\dfrac{101}{145}\cdot22,4\approx15,6\left(l\right)\end{matrix}\right.\)
Câu 1:
Thu được khí CO
PTHH: \(CO_2+2NaOH\rightarrow Na_2CO_3+H_2O\)
\(Cl_2+2NaOH\rightarrow NaCl+NaClO+H_2O\)