Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

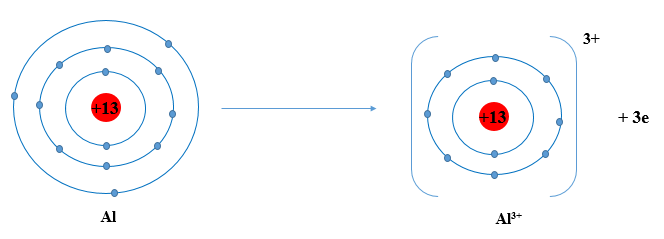
Aluminium (Al) thuộc ô số 13, chu kì 3, nhóm IIIA trong bảng tuần hoàn.
Nguyên tử aluminium nhường 3 electron ở lớp ngoài cùng để trở thành ion aluminium, kí hiệu Al3+
Sơ đồ tạo thành ion aluminium:

- Nguyên tử N nằm ở ô số 7, nhóm VA => Có 5 electron ở lớp ngoài cùng, cần 3 electron để đạt cấu hình khí hiếm
- Nguyên tử C nằm ở ô số 6, nhóm IVA => Có 4 electron ở lớp ngoài cùng, cần 4 electron để đạt cấu hình khí hiếm
- Nguyên tử O nằm ở ô số 8, nhóm VIA => Có 6 electron ở lớp ngoài cùng, cần 2 electron để đạt cấu hình khí hiếm
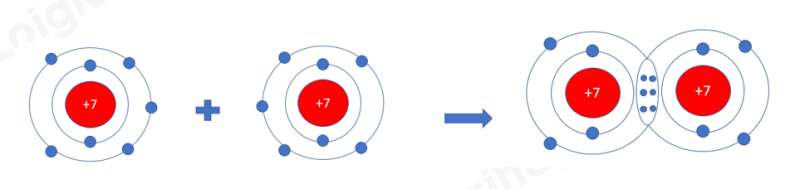
a) Xét phân tử Nitrogen: gồm 2 nguyên tử N
=> Liên kết cộng hóa trị, mỗi N góp 3 electron tạo thành 3 cặp electron dùng chung
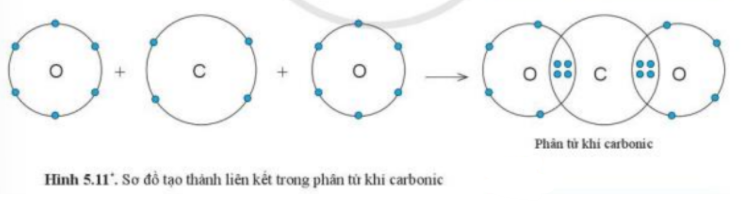
b) Xét phân tử Carbon dioxide: gồm 1 nguyên tử C và 2 nguyên tử O
=> Liên kết cộng hóa trị. Khi C kết hợp với O, nguyên tử C góp 4 electron, mỗi nguyên tử O góp 2 electron
=> Giữa nguyên tử C và nguyên tử O có 2 cặp electron dùng chung

Số hạt mang điện là:(40 + 12): 2 = 26 hạt
Số hạt không mang điện là: 40 - 26 = 14 hạt
Nguyên tố x là Fe(sắt) vì trong bảng tuần hoàn hoá học điện tích hạt nhân của Fe = 26.

CTHH : `SO_2`
gọi hóa trị của lưu huỳnh là x
ta có
\(x\cdot1=II\cdot2\\ =>x=4\)
vậy hóa trị của lưu huỳnh là IV

Oxygen (KHHH: O):
- STT: 8
- Chu kì: 2
- Nhóm: VIA
Chlorine (KHHH: Cl)
- STT: 17
- Chu kì: 3
- Nhóm: VIIA
Sulfur (KHHH: S)
- STT: 16
- Nhóm: 3
- Chu kì: VIA
Bromine (KHHH: Br)
- STT: 35
- Chu kì: 4
- Nhóm: VIIA

- Ô: Các nguyên tố hoá học được xếp theo chiều tăng dần của điện tích hạt nhân.
- Nhóm ( Cột ) : Các nguyên tố trong cùng cột có tính chất giống nhau ( đều có cùng số electron ở lớp ngoài cùng ).
- Chu kì ( Hàng ) : Các nguyên tố hoá học trong cùng hàng có cùng số lớp electron trong nguyên tử.
( Trong sách giáo khoa - Kết nối tri thức trang 24 nha )
\(#2024vv\)

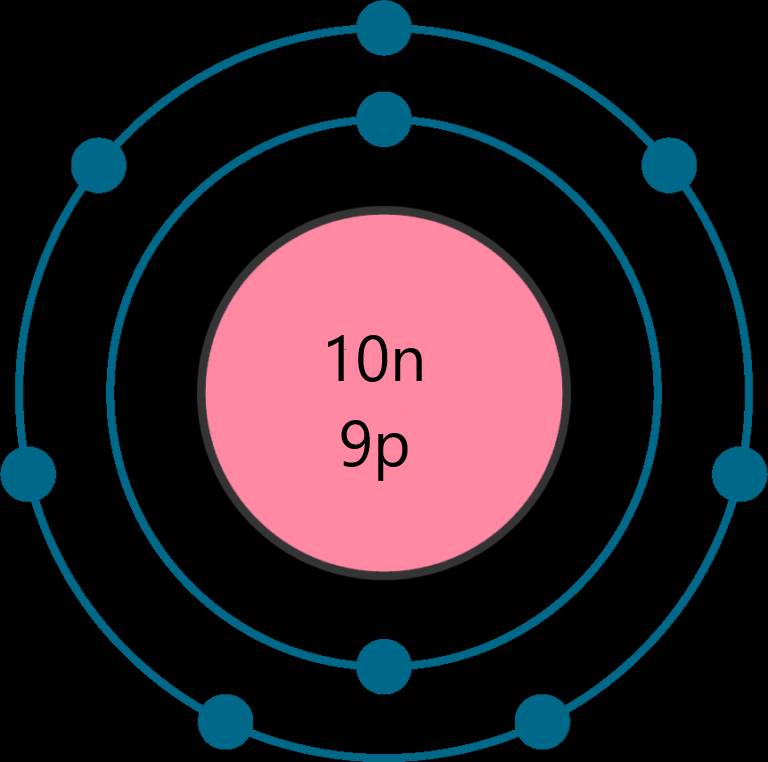

Nguyên tố sulfur (S) thuộc ô thứ 16, chu kì 3, nhóm VIA trong bảng tuần hoàn.
Nguyên tử sulfur nhận thêm 2 electron để trở thành ion ion sulfide (S2-). Ion sulfide (S2-) có 8 electron lớp ngoài cùng, sự phân bố electron trên ion sulfide (S2-) giống với sự phân bố electron của nguyên tử khí hiếm argon (Ar).