Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
Lập tỉ lệ :
\(\dfrac{0.3}{2}< \dfrac{0.2}{1}\)
\(\Rightarrow H_2SO_4dư\)
\(m_{Na_2SO_4}=0.15\cdot142=21.3\left(g\right)\)
\(m_{H_2SO_4\left(dư\right)}=\left(0.2-0.15\right)\cdot98=4.9\left(g\right)\)

Làm gì có axit H3PO2 nhỉ chỉ có H3PO3 với H3PO4 thôi
=> Xem lại đề kĩ lại nhé :D
https://en.intl.chemicalaid.com/tools/equationbalancer.php?equation=H3PO2+%2B+NaOH+%3D+NaH2PO2+%2B+H2O
:v

PTHH: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\)
a) Ta có: \(\left\{{}\begin{matrix}n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\\n_{H_2SO_4}=\dfrac{200\cdot4,9\%}{98}=0,1\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Cả 2 chất p/ứ hết
b+c) Theo PTHH: \(n_{ZnSO_4}=n_{H_2}=n_{Zn}=0,1\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}m_{ZnSO_4}=0,1\cdot161=16,1\left(g\right)\\m_{H_2}=0,1\cdot2=0,2\left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{dd}=m_{Zn}+m_{ddH_2SO_4}-m_{H_2}=206,3\left(g\right)\)
\(\Rightarrow C\%_{ZnSO_4}=\dfrac{16,1}{206,3}\cdot100\%\approx7,8\%\)

a) \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
b) \(n_{H_2SO_4}=\dfrac{m_{H_2SO_4}}{M_{H_2SO_4}}=\dfrac{49}{98}=0,5\left(mol\right)\)
Theo PTHH ta thấy:
\(\dfrac{n_{Zn}}{1}=\dfrac{0,2}{1}\)
\(\dfrac{n_{H_2SO_4}}{1}=\dfrac{0,5}{1}\)
\(\Rightarrow\dfrac{n_{Zn}}{1}< \dfrac{n_{H_2SO_4}}{1}\)
Vậy axit sunfuric dư
c) Theo PTHH: \(n_{H_2}=n_{Zn}=0,2\left(mol\right)\)
\(\Rightarrow V_{H_2}=n_{H_2}.22,4=0,2.22,4=4,48\)
a)\(PTHH:Zn+H_{ 2}SO_4\xrightarrow[]{}ZnSO_4+H_2\)
b)\(n_{H_2SO_4}=\dfrac{49}{98}=0,5\left(m\right)\)
\(PTHH:Zn+H_2SO_4\xrightarrow[]{}ZnSO_4+H_2\)
tỉ lệ :1 1 1 1
số mol bđ :0,2 0,5
ta có tỉ lệ : \(\dfrac{0,2}{1}< \dfrac{0,5}{1}=>H_2SO_4\) \(dư\)
vậy sau phản ứng \(H_2SO_4\) \(dư\)
c)\(PTHH:Zn+H_2SO_4\xrightarrow[]{}ZnSO_4+H_2\)
tỉ lệ :1 1 1 1
số mol :0,2 0,2 0,2 0,2
\(V_{H_2}=0,2.22,4=4,48\left(l\right)\)

a) Mg + 2HCl --> MgCl2 + H2
b) Xét tỉ lệ: \(\dfrac{0,15}{1}>\dfrac{0,2}{2}\) => HCl hết, Mg dư
PTHH: Mg + 2HCl --> MgCl2 + H2
0,1<--0,2-------------->0,1
=> VH2 = 0,1.22,4 = 2,24 (l)
c) mMg(dư) = 24(0,15 - 0,1) = 1,2 (g)
a) Mg (0,1 mol) + 2HCl (0,2 mol) \(\rightarrow\) MgCl2 + H2\(\uparrow\) (0,1 mol).
b) Thể tích khí hiđro thu được là 0,1.22,4=2,24 (lít).
c) Khối lượng magie dư sau phản ứng là (0,15-0,1).24=1,2 (g).

n Zn = 26/65 = 0,4(mol)
$Zn + 2HCl \to ZnCl_2 + H_2$
Ta thấy:
n Zn / 1 = 0,4 > n HCl / 2 = 0,25 nên Zn dư
Theo PTHH :
n Zn pư = 1/2 n HCl = 0,25(mol)
Suy ra: m Zn dư = 26 - 0,25.65 = 9,75 gam

a) \(\left\{{}\begin{matrix}n_{HCl}=0,5\\n_{H_2SO_4}=0,19\end{matrix}\right.\)
Gọi công thức chung của 2 axit là HX
=> nHX = 0,5 + 0,19.2 = 0,88 (mol)
\(n_{H_2}=\dfrac{8,736}{22,4}=0,39\left(mol\right)\)
Do nHX > 2.nH2 => axit còn dư sau pư
b) bài này s tính riêng đc mỗi muối :v

a. Đổi 200 ml = 0,2 lít
\(n_{Fe}=\dfrac{11.2}{56}=0,2\left(mol\right)\)
\(n_{HCl}=2.0,2=0,2\left(mol\right)\)
PTHH : Fe + 2HCl -> FeCl2 + H2
0,1 0,2 0,1 0,1
Ta thấy : \(\dfrac{0.2}{1}>\dfrac{0.2}{2}\) => Fe dư , HCl đủ
\(m_{Fe\left(dư\right)}=\left(0,2-0,1\right).56=5,6\left(g\right)\)
b. \(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c. Sau phản ứng chất tan là FeCl2
\(V_{FeCl_2}=0,1.2=0,2\left(l\right)\)
\(\Rightarrow C_{M_{FeCl_2}}=\dfrac{0.1}{0,2}=0,5\left(M\right)\)

\(1.3NaOH+H_3PO_4\rightarrow Na_3PO_4+3H_2O\\ a=n_{H_3PO_4}=\dfrac{1}{3}n_{NaOH}=\dfrac{1}{3}\cdot0,9=0,3mol\\ \Rightarrow A\\ 2.n_{Ba\left(OH\right)_2}=0,2.0,4=0,08mol\\ n_{H_2SO_4}=0,25.0,3=0,075mol\\ Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4+2H_2O\\ \Rightarrow\dfrac{0,08}{1}>\dfrac{0,075}{1}\Rightarrow Ba\left(OH\right)_2.dư\\ n_{BaSO_4}=n_{H_2SO_4}=0,075mol\\ m_{\uparrow}=m_{BaSO_4}=0,075.233=16,725g\\ \Rightarrow?:))\\ 3.n_{KOH}=0,2.1=0,2mol\\ n_{H_2SO_4}=0,2.1=0,2mol\\ 2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O\\ \Rightarrow\dfrac{0,2}{2}< \dfrac{0,2}{1}\Rightarrow H_2SO_4.dư\\ n_{H_2SO_4.pư}=\dfrac{1}{2}n_{KOH}=\dfrac{1}{2}\cdot0,2=0,1mol\\ n_{H_2SO_4_4.dư}=0,2-0,1mol\\ H_2SO_4+Mg\rightarrow MgSO_4+H_2\\ n_{H_2}=n_{H_2SO_4.dư}=0,1mol\\ V_{H_2}=0,1.24,79=2,479l\\ \Rightarrow A\)

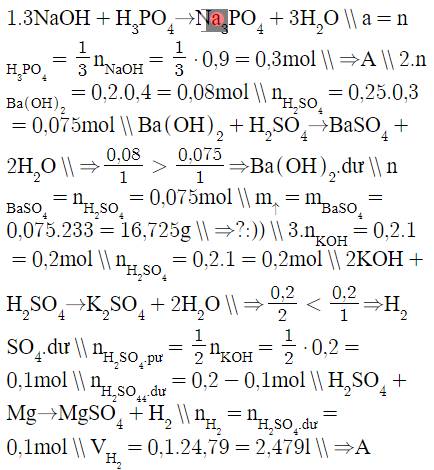
a, PT: \(H_2SO_4+2NaOH\rightarrow Na_2SO_4+2H_2O\)
Xét tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,2}{2}\), ta được H2SO4 dư.
→ Dd sau pư làm quỳ tím hóa đỏ.
b, Theo PT: \(n_{H_2SO_4\left(pư\right)}=\dfrac{1}{2}n_{NaOH}=0,1\left(mol\right)\)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=0,2-0,1=0,1\left(mol\right)\)