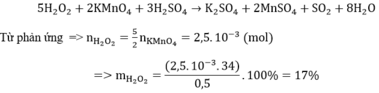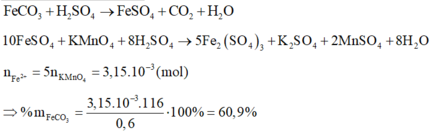Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

HD:
Sản phẩm cháy gồm CO2 và H2O cho đi qua bình 1 chỉ có H2O bị hấp thụ, bình 2 có CO2 bị hấp thụ.
Do đó, số mol H2O = 1,8/18 = 0,1 mol. Suy ra số mol H = 0,2 mol.
Số mol C = số mol CO2 = số mol kết tủa CaCO3 = 8/100 = 0,08 mol.
Như vậy tổng khối lượng của H + C = 0,2 + 0,08.12 = 1,16 g = đúng khối lượng của A. Vì vậy hợp chất A chỉ chứa C và H.
Đặt công thức A là CxHy, ta có phản ứng:
CxHy + O2 \(\rightarrow\) xCO2 + y/2H2O
0,02 0,08 0,1
Khối lượng phân tử của A = 29.2 = 58, do đó số mol của A = 1,16/58 = 0,02 mol.
Theo phương trình trên ta có: x = 4, y = 10. Công thức của A là C4H10 (Butan).
Các công thức cấu tạo: CH3-CH2-CH2-CH3 (n-butan); CH3-CH(CH3)-CH3 (iso-butan hoặc 2-metyl propan)
Phản ứng clo hóa theo tỉ lệ 1:1 như sau:
CH3-CH2-CH2-CH3 + Cl2 \(\rightarrow\) CH3-CH2-CH2-CH2Cl (sản phẩm chính) + HCl hoặc CH3-CH2-CH2-CH3 + Cl2 \(\rightarrow\) CH3-CHCl-CH2-CH3 + HCl
CH3-CH(CH3)-CH3 + Cl2 \(\rightarrow\) CH3-CH(CH3)-CH2Cl (sản phẩm chính) + HCl hoặc CH3-CH(CH3)-CH3 + Cl2 \(\rightarrow\) CH3-CCl(CH3)-CH3 + HCl

\(Đặt:m_{Ag}=a\left(a>0\right)\left(g\right)\\ 3Ag+4HNO_3\rightarrow3AgNO_3+NO+2H_2O\\ AgNO_3+HCl\rightarrow AgCl+HNO_3\\ n_{AgCl}=n_{AgNO_3}=n_{Ag}=\dfrac{a}{108}\left(mol\right)\\ m_{\downarrow}=\left(0,5-a\right)+\dfrac{a}{108}.143,5\\ \Leftrightarrow0,398=\left(0,5-a\right)+\dfrac{143,5}{108}a\\ \Leftrightarrow a=\left(âm\right)??\)

Ag → Ag+ + 1e
Ag+ + HCl → AgCl ↓ + H+
Số mol kết tủa là
nAgCl = 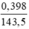 (mol)
(mol)
Theo pt nAg = nAg+ = nAgCl = 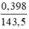 (mol)
(mol)
Khối lượng Ag là: mAg = 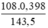 = 0,3 (g)
= 0,3 (g)
%mAg= 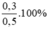 = 60%
= 60%

Đáp án B
nKMnO4 = 6,3.10-4 (mol)
Phản ứng chuẩn độ
![]()
nFeSO4 = 5nKMnO4 = 3,15.10-3 mol = nFe2+ = nFeCO3
=> Khối lượng FeCO3: mFeCO3 = 3,15.10-3.116 = 0,3654 (gam)
%mFeCO3 = 0,3654 : 0,6 x 100 = 60,9%