Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Để thu NH3 với hiệu suất cao, cân bằng phải chuyển dịch theo chiều thuận.
- Giảm nhiệt độ do pư tỏa nhiệt.
- Tăng nồng độ N2
- Giảm nồng độ NH3
- Tăng áp suất
- Chất xúc tác chỉ làm tăng tốc độ pư theo cả 2 chiều → không ảnh hưởng đến chuyển dịch cân bằng.

Lấy dư carboxylic hoặc alcohol.
Thu hồi ester tạo thành khỏi khu vực phản ứng.

Cùng điều kiện nhiệt độ và áp suất tỉ lệ thể tích chính là tỉ lệ số mol
VC4H10 phản ứng = Vkhí tăng = VA – VC4H10 ban đầu = 16l
⇒ H = (16 : 40).100% =40%
Đáp án A.

Đáp án : A
Do tỉ lệ thể tích bằng tỉ lệ số mol, coi 40l = 40mol, 56l = 56mol
Do cracking nên không thêm chất bên ngoài vào, vậy lượng chênh lệch trước và sau phản ứng chính là lượng butan phản ứng có số mol: 56 - 40 = 16 mol
=> H = 16/40 = 40%

N 2 (k) + 3 H 2 (k) ↔ 2 N H 3 (k)
ΔH = -92 kJ
1. Khi tăng áp suất chung, cân bằng chuyển dịch theo chiều từ trái sang phải là chiều tạo ra số mol khí ít hơn.
2. Khi giảm nhiệt độ, cân bằng chuyển dịch theo chiéu từ trái sang phải là chiều của phản ứng toả nhiệt.

a, \(N_2+3H_2⇌2NH_3\)
b, Ta có: \(K_c=\dfrac{\left[NH_3\right]^2}{\left[N_2\right]\left[H_2\right]^3}=\dfrac{0,62^2}{0,45.0,14^3}\approx311,31\)
c, - Tăng nhiệt độ → giảm hiệu suất.
- Tăng áp suất → tăng hiệu suất.
- Thêm bột sắt (xúc tác) → không làm thay đổi hiệu suất.

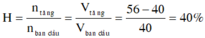
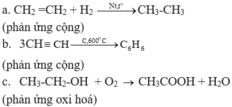
- Trong các phản ứng hoá học, loại phản ứng trong đó các chất sản phẩm có khả năng phản ứng để tạo thành các chất đầu được gọi là phản ứng thuận nghịch.
- Để tăng hiệu suất của chúng, cần điều chỉnh những điều kiện phản ứng như nhiệt độ, áp suất, nồng độ,... dựa theo nguyên lí Le Chatelier: “Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động đó”.