Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nBa(OH)2 = 0,002 mol; nKOH = 0,006 mol → ∑ n O H - = 0,002.2 + 0,006 = 0,01 mol
→ [OH-] = n V = 0 , 01 0 , 2 + 0 , 2 = 0,025 → pOH = –lg[OH-] = -lg0,025 = 1,6
Mà pH + pOH = 14 → pH = 12,4
Đáp án C

Chọn C
Số mol Ba ( OH ) 2 = 0,2.0,01 = 0,002 mol; Số mol KOH = 0,2.0,03 = 0,006 mol
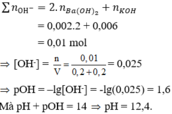

\(n_{H^+}=n_{HCl}=0,5.0,3=0,15\left(mol\right)\\ n_{OH^-}=2.n_{Ba\left(OH\right)_2}=0,2.a.2=0,4a\left(mol\right)\\ Vì:pH=1\Rightarrow-log\left[H^+\right]=1\\ \Leftrightarrow\left[H^+\right]=0,1\left(M\right)\\ \Rightarrow\dfrac{n_{H^+\left(dư\right)}}{0,5}=0,1\\ \Rightarrow n_{H^+\left(dư\right)}=0,05\left(mol\right)\\ \Rightarrow0,15-0,4a=0,05\\ \Leftrightarrow a=0,25\)

a, \(n_{H^+}=0,025.0,2=0,005\left(mol\right)\)
\(n_{OH^-}=0,01.2.0,3=0,006\left(mol\right)\)
\(\Rightarrow n_{OH^-dư}=0,001\left(mol\right)\)
\(\Rightarrow\left[OH^-\right]_{dư}=\dfrac{0,001}{1}=10^{-3}\)
\(\Rightarrow\left[H^+\right]=10^{-11}\)
\(\Rightarrow pH=11\)
b, \(n_{Fe^{2+}}=n_{SO_4^{2-}}=0,02.0,1=0,002\left(mol\right)\)
\(n_{Ba^{2+}}=0,01.0,3=0,003\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{BaSO_4\downarrow}=n_{SO_4^{2-}}=0,002\left(mol\right)\\n_{Fe\left(OH\right)_2\downarrow}=n_{OH^-dư}=0,001\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{\downarrow}=0,002.233+0,001.90=0,556\left(g\right)\)

Câu 1:
PT ion: \(H^++OH^-\rightarrow H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{OH^-}=0,6\cdot0,4+0,6\cdot0,3\cdot2=0,6\left(mol\right)\\n_{H^+}=0,2\cdot2,6=0,52\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\) H+ hết, OH- còn dư \(\Rightarrow n_{OH^-\left(dư\right)}=0,08\left(mol\right)\)
\(\Rightarrow\left[OH^-\right]=\dfrac{0,08}{0,6+0,2}=0,1\left(M\right)\) \(\Rightarrow pH=14+log\left(0,1\right)=13\)
Bài 2:
PT ion: \(H^++OH^-\rightarrow H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{OH^-}=0,3\cdot1,6=0,48\left(mol\right)\\n_{H^+}=0,2\cdot1\cdot2+0,2\cdot2=0,8\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\) OH- hết, H+ còn dư \(\Rightarrow n_{H^+\left(dư\right)}=0,32\left(mol\right)\)
\(\Rightarrow\left[H^+\right]=\dfrac{0,32}{0,2+0,3}=0,64\left(M\right)\) \(\Rightarrow pH=-log\left(0,64\right)\approx0,19\)
nBa(OH)2 = 0,002 mol; nKOH = 0,006 mol → ∑ n O H - = 0,002.2 + 0,006 = 0,01 mol
→ [OH-] = n V = 0 , 01 0 , 2 + 0 , 2 = 0,025 → pOH = –lg[OH-] = -lg0,025 = 1,6
Mà pH + pOH = 14 → pH = 12,4
Đáp án C