Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
∑ nH+ = 2nH2SO4 + nHCl = 2. 0,1.0,05 + 0,1.0,1 = 0,02 (mol)
∑ nOH- = nNaOH + 2nBa(OH)2 = 0,1.0,2 + 2. 0,1.0,1 = 0,04 (mol)
H+ + OH- → H2O
0,02 → 0,02
=> nOH- dư = 0,04 – 0,02 = 0,02 (mol)
=> [OH-] = n: V = 0,02 : 0,2 = 0,01 M
pH = 14 + log(OH-) = 14 + (-1) = 13
Chú ý:
pH được tính theo giá trị của log[H+] chứ không phải log [OH-]

Đáp án C
nH+ = 0,02 mol; nOH-= 0,04 mol
H+ + OH- → H2O
0,02 0,04
nOH- dư = 0,02 mol; [OH-] dư = 0,02/0,2 = 0,1M suy ra [H+] = 10-13 M suy ra pH = 13

Đáp án B
nH+ = 0,1 .2.0,05 + 0,1.0,1 =0,02
nOH- = 0,1.0,2 + 0,1.0,1.2 = 0,04
⇒ Trong dung dịch sau phản ứng có nOH- dư = 0,04 – 0,02 = 0,02 mol
V dd thu = 100 + 100 = 200ml
⇒ [OH-] = 0,1 ⇒ pH = 13
Đáp án B.

Đáp án B
nOH- = 0,1.2.0,1 + 0,1.0,1 = 0,03
nH+ = 0,4.2.0,0375 + 0,4.0,0125 = 0,035
⇒ Trong X có H+ dư
⇒ nH+/X =0,035 – 0,03 = 0,005; VX = 100 + 400 = 500ml
⇒ [H+] = 0,01 ⇒ pH = 2.

Chọn D
Trộn 3 dung dịch với thể tích bằng nhau thu được 150 ml dung dịch X → mỗi dung dịch lấy 50ml.
→ n H + = 0,05.0,2 + 0,05.2.0,1 + 0,05.0,08 = 0,024 mol.
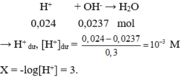

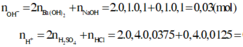
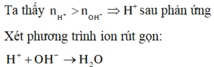
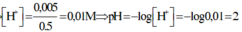

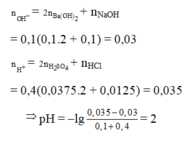

`100mL=0,1L`
`n_{H^+}=0,1.0,05.2+0,1.0,1=0,02(mol)`
`n_{SO_4^{2-}}=0,1.0,05=0,005(mol)`
`n_{OH^-}=0,1.0,2+0,1.0,1.2=0,04(mol)`
`n_{Ba^{2+}}=0,1.0,1=0,01(mol)`
`Ba^{2+}+SO_4^{2-}->BaSO_4`
Do `0,01>0,005->` Tính theo `SO_4^{2-}`
`n_{BaSO_4}=n_{SO_4^{2-}}=0,005(mol)`
`->m_↓=0,005.233=1,165(g)`
`H^{+}+OH^{-}->H_2O`
Do `0,02<0,04->OH^-` dư
`n_{OH^{-}\ pu}=n_{H^+}=0,02(mol)`
`->n_{OH^{-}\ du}=0,04-0,02=0,02(mol)`
Trong X: `[OH^-]={0,02}/{0,1+0,1}=0,1M`
`->pH=14-pOH=14+lg[OH^-]=13`