Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Dung dịch axit ban đầu có [H+] = 0,1 M
⇒ nH+= 0,1.0,1 = 0,01 mol
Dung dịch sau phản ứng có pH = 12
⇒ dư bazơ và có pOH =14 – 12 = 2
⇒ [OH-] = 0,01M
⇒ nOH− dư = 0,002 mol
Phản ứng trung hòa:
nH+phản ứng = nOH−phản ứng = 0,01 mol
⇒ nNaOH ban đầu = nOH−phản ứng + nOH− dư
= 0,01 + 0,002 = 0,012 mol
⇒ a = 0,12M

a)
$NaOH + HCl \to NaCl + H_2O$
$OH^- + H^+ \to H_2O$
b)
$n_{HCl} = 0,1.0,01 = 0,001(mol)$
$n_{NaOH} = 0,2.0,5= 0,1(mol)$
$\Rightarrow$ NaOH dư, HCl hết
$n_{NaOH\ pư} = 0,001 \Rightarrow n_{NaOH\ dư} = 0,1 - 0,001 = 0,099(mol)$
$\Rightarrow [OH^-] = \dfrac{0,099}{0,1 + 0,2} = 0,33M$
$\Rightarrow pOH = -log(0,33) = 0,48 $
$pH = 14 - pOH = 14 - 0,48 = 13,52$

Đáp án D
nOH- = 0,01.2 = 0,02
nH+ = 0,2 . 0,04 = 0,008
⇒ Trong dung dịch B có nOH- = 0,02 – 0,008 = 0,012
VB = 1,2 . 10 = 12l ⇒ [OH-] = 0,001
⇒ pH = 11

\(pH=14+log\left[OH^-\right]=13\)
\(\Rightarrow\left[OH^-\right]=0.1\)
\(n_{NaOH}=0.1\cdot0.05=0.005\left(mol\right)\)
Dung dịch sau phản ứng có pH = 2
=> HCl dư
\(NaOH+HCl\rightarrow NaCl+H_2O\)
\(0.005........0.005\)
\(C_{M_{HCl\left(bđ\right)}}=a\left(M\right)\)
\(n_{HCl\left(dư\right)}=0.05a-0.005\left(mol\right)\)
\(\left[H^+\right]=\dfrac{0.05a-0.005}{0.005+0.005}=\dfrac{10a-1}{2}\)
\(pH=-log\left(\dfrac{10a-1}{2}\right)=2\)
\(\Rightarrow a=0.102\)
\(n_{HCl}=0.05\cdot0.102=0.0051\left(mol\right)\)

Ta có: \(pH=1\Rightarrow\left[H^+\right]=0,1\Rightarrow n_{H^+}=0,1.0,1=0,01\left(mol\right)\)
Sau pư, pH = 12 ⇒ OH- dư.
\(\Rightarrow\left[OH^-\right]_{\left(dư\right)}=\frac{10^{-14}}{10^{-12}}=0,01\Rightarrow n_{OH^-\left(dư\right)}=0,01.0,2=0,002\left(mol\right)\)
PT ion: \(H^++OH_{\left(pư\right)}^-\rightarrow H_2O\)
_______0,01 → 0,01 (mol)
\(\Rightarrow\Sigma n_{OH^-}=0,01+0,002=0,012\left(mol\right)\)
\(\Rightarrow\left[OH^-\right]=\frac{0,012}{0,1}=0,12M=a\)
Bạn tham khảo nhé!

Đáp án D
nH2SO4 = 0,005 .0,25 =0,00125(mol)
nHCl = 0,01. 0,25= 0,0025 (mol)
∑n= 0,00125 + 0,0025= 0,00375 (mol)
∑n= 0,001.0,2 + 0,0005.2.0,2=0,0004
H+ + OH- → H2O
Ban đầu: 0,00375 0,0004
Phản ứng: 0,0004 0,0004
Sau phản ứng: 0,00335 0
Vsau = 0,2 + 0,25= 0,45(lít)
Mà 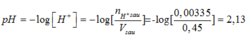
a. nHCl = 10-2. 0,01 = 10-4 mol
=> Nồng độ H+ sau pha = 10-4: (0,09 + 0,01) = 10-3 => pH dd sau pha = 3
b. nồng độ H+ sau pha = [(10-2. 0,1) + (10-3. 0,1)] : 0,2 = 0,0055M
=> pH dd sau pha = -lg(0,0055) = 2,26
c. nOH- = 0,3. 0,01 = 0,003. nH+ = 0,2. 0,01 = 0,002
=> OH- dư = 0,003 - 0,002 = 0,001 => nồng độ OH- = 0,001: (0,3+0,2) = 0,002M => pOH = -lg0,002 = 2,7 => pH = 14 - 2,7 = 11,3