Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án D
m H F = 400 . 40 100 = 160 (gam) → n H F = 160 20 = 8 (mol)
Bảo toàn F có: n H F = 2. n C a F 2 → n C a F 2 = 4 mol.
m C a F 2 = 4 , 78 80 % = 390 (gam)

Chọn đáp án C
m H F = 200 . 40 100 = 80 (gam) => n H F = 80 20 = 4 (mol)
m C a F 2 = 4 . 1 2 . 78 . 100 80 = 195 (gam)

Đáp án D
![]() .100 = 40% => mHF =160 (g) => n HF = 8 (mol)
.100 = 40% => mHF =160 (g) => n HF = 8 (mol)
CaF2 + H2SO4 → CaSO4 + 2HF
4 ← 8 (mol)
Do H% = 60%=> ![]() = 5 mol
= 5 mol
m = 5. (40+19.2) = 390 (g)

PT: \(2Na+Cl_2\underrightarrow{t^o}2NaCl\)
Ta có: \(n_{NaCl}=\dfrac{4,68}{58,5}=0,08\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{Na\left(LT\right)}=n_{NaCl}=0,08\left(mol\right)\\n_{Cl_2\left(LT\right)}=\dfrac{1}{2}n_{NaCl}=0,04\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Na\left(LT\right)}=0,08.23=1,84\left(g\right)\\V_{Cl_2\left(LT\right)}=0,04.22,4=0,896\left(l\right)\end{matrix}\right.\)
Mà: H% = 80%
\(\Rightarrow\left\{{}\begin{matrix}m_{Na\left(TT\right)}=\dfrac{1,84}{80\%}=2,3\left(g\right)\\V_{Cl_2\left(TT\right)}=\dfrac{0,896}{80\%}=1,12\left(l\right)\end{matrix}\right.\)
Bạn tham khảo nhé!

Ta có nCl2 = 8,96/22,4 = 0,4 mol
PTHH :
2KMnO4 + 16HCl - > 2KCl + 2MnCl2 + 5Cl2 + 8H2O
0,16mol.........1,28mol...............................0,4mol
=> Khối lượng của KMnO4 là : mKMnO4 = 0,16.158=25,28(g)
Khối lượng dd HCl là : mddHCl = \(\frac{1,28.36,5.100}{19,2}\approx243,33\left(g\right)\)
Vì hiệu suất là 80% nên
=> \(\left\{{}\begin{matrix}mKMnO4=\frac{25,28.80}{100}=20,224\left(g\right)\\mddHCl=\frac{243,33.80}{100}=194,664\left(g\right)\end{matrix}\right.\)

1.
mNaCl lí thuyết = \(\dfrac{4,68.100}{80}\) = 5,85 (g)
=> nNaCl lí thuyết = \(\dfrac{5,85}{58,5}\) = 0,1 (mol)
2Na + Cl2 ----> 2NaCl
0,1 0,05 0,1 (mol)
=> mNa = 0,1.23 = 2,3 (g)
=> VCl2 = 0,05.22,4 = 1,12 (l)
2.
nZn = \(\dfrac{19,5}{65}\)= 0,3 (mol)
nCl2 = \(\dfrac{7}{22,4}\)= 0,3125 (mol)
Zn + Cl2 ----> ZnCl2
0,3 0,3 (mol)
Tỉ lệ: \(\dfrac{0,3}{1}<\dfrac{0,3125}{1}\)=> Zn phản ứng hết, Cl2 phản ứng dư.
=> mZnCl2 lí thuyết 0,3.136 = 40,8 (g)
=> H = \(\dfrac{36,72.100}{40,8}\)= 90%
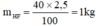
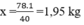
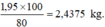

mHF =\(\frac{40.2,5}{100}\) = 1kg
Phương trình phản ứng hóa học:
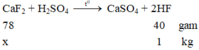
CaF2 + H2SO4 ---> CaSO4 + 2HF
78kg 40kg
X kg 1 kg
mCaF2 cần dùng: \(\frac{1.78}{40}.\frac{100}{80}\) = 2,4375 kg
mHF =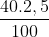 = 1kg
= 1kg
Phương trình phản ứng hóa học:
CaF2 + H2SO4 CaSO4 + 2HF
78kg 40kg
X kg 1 kg