Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Ban đầu: Ca(OH)2 + CO2 → CaCO3 + H2O
Kết tủa xuất hiện làm giảm số lượng các ion trong dung dịch → điện tích giảm. → đèn sáng yếu đi.
Sau đó: CaCO3 + CO2 + H2O → Ca(HCO3)2.
Kết tủa tan ra tạo thêm nhiều điện tích (ion) hơn làm cho đèn sáng dần lên

2 đúng vì thế điện cực của kim loại kiềm rất âm
Từ Li đến Cs theo chiều điện tích hạt nhân tăng dần số lớp electron tăng => Bán kính tăng => Khả năng tách electron hóa trị tăng => 4 đúng và 1 sai
Các kim loại từ Li đến Cs đều có ánh kim => 3 đúng
5 sai vì nhiệt độ nóng chảy và nhiệt độ sôi giảm dần từ Li đến Cs.
Đáp án cần chọn là: C

a. Thí nghiệm 1:
FeSO4 + 2NaOH → Fe(OH)2 + Na2SO4 (1)
Fe2(SO4)3 + 6NaOH → 2Fe(OH)3 + 3NaCl (2)
Thí nghiệm 2:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O (5)
nFeSO4 = 5nKMnO4 = 5.0,01.0,2 = 0,01 mol
Theo các phương trình hóa học (1,3) ⇒ nFe2O3 (3) = 1/2 . nFeSO4 = 0,005
⇒ nFe2(SO4)3 ban đầu = nFe2O3 – nFe2O3 (3) = 1,2/160 - 0,005 = 0,0025 mol
b. Xác định nồng độ mol
CM FeSO4 = 0,01/0,02 = 0,5 M
CM Fe2(SO4)3 = 0,0025/0,02 = 0,125 M
c. Ngâm một đinh sắt vào A sẽ loại được Fe2(SO4)3
Fe + Fe2(SO4)3 → 3FeSO4

Đáp án C
Các phát biểu đúng là a, c, e.
b sai do Be không tác dụng với H2O, Mg không phản ứng với nước ở nhiệt độ thường.
d sai theo chiều tăng dần điện tích hạt nhân thì nhiệt độ nóng chảy của kim loại kiềm thổ biến đổi không theo quy luật.
f sai do CrO3, K2Cr2O7 có tính oxi hóa rất mạnh.
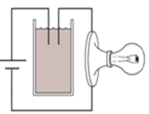
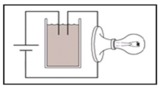
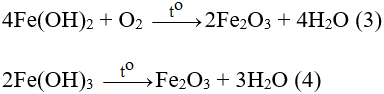
+ Khi CO2 vào thì ban đầu nước vôi trong dư so với CO2 nên ion Ca2+ dần đến hết vì bị kết tủa thành CaCO3
=> lượng ion trong dung dịch giảm dần về 0
+ Khi CO2 dư thì kết tủa lại bị hòa tan, tạo thành ion Ca2+ và HCO3-
=> lượng ion tăng dần
Vậy đèn có độ sáng giảm dần đến tắt rồi lại sáng tăng dần.
Đáp án A