

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Đáp án A
mdung dịch = 200.1,1 = 220 (g); nNaOH = nNaCl = 0,2.2 = 0,4 (mol)
dễ thấy khí thoát ra ở catot là H2 với = 1 (mol)


Đáp án D
Vì ở anot có Cl- bị điện phân trước và chỉ thu được một khí duy nhất nên khí đó là Cl2.
⇒ n C l 2 = 0 , 14
Vì cho dung dịch sau điện phân phản ứng với dung dịch NaOH có kết tủa nên Cu2+ chưa bị điện phân hết, khi đó chưa có sự điện phân H+.
Tóm tắt toàn bộ quá trình:
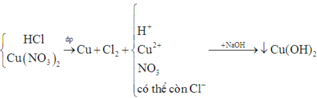
Áp dụng định luật bảo toàn mol electron, ta có: 2nCu = 2 n C l 2 ⇒ n C u = 0,14


Đáp án C
TH1: Cl- bị đp hết trước Cu2+, H2O ở anot bị điện phân
Al2O3+6H+→2Al3++3H2O
0,2.…1,2
Catot:
Cu2+ + 2e → Cu
Anot:
Cl- -1e → 0,5Cl2
H2O - 2e→0,5O2 + 2H+
0,3 1,2
Ta thấy nO2=0,3 => nCl2 = 0 (vô lí)
TH2: Cu2+ bị điện phân hết trước Cl-, H2O ở catot bị điện phân sinh ra OH-
Al2O3+2OH-→2AlO2-+H2O
0,2…….0,4
Catot:
Cu2+ +2e→Cu
x 2x
H2O+1e→OH-+0,5H2
0,4 0,4
Anot:
Cl- -1e → 0,5Cl2
0,6...0,3
=>2x+0,4=0,6=>x=0,1 mol
=>nCuSO4=0,1 mol; nNaCl=0,6 mol
=>m=0,1.160+0,6.58,5=51,1 gam