Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

-Vì khối lượng hỗn hợp kim loại ở 2 trường hợp đều bằng nhau. Chỉ thay đổi lượng HCl. Do trường hợp 800ml HCl thì khối lượng chất rắn tăng lên nên nếu với 500ml HCl mà kim loại hết thì khi tăng lên 800ml HCl thì khối lượng chất rắn không thể tăng lên nữa nên:
-Trường hợp 500ml HCl thì hỗn hợp kim loại dư, HCl hết.
-Trường hợp 500ml HCl thì hỗn hợp kim loại hết, HCl dư.
-Ta sẽ tìm khối lượng mỗi kim loại trong trường hợp 800ml HCl:
-Gọi \(n_{Zn}=x;n_{Fe}=y\)
Zn+2HCl\(\rightarrow\)ZnCl2+H2
Fe+2HCl\(\rightarrow\)FeCl2+H2
Chất rắn thu được là ZnCl2 x mol và FeCl2 y mol
hệ: \(\left\{{}\begin{matrix}65x+56y=18,6\\136x+127y=39,9\end{matrix}\right.\)
giải ra x=0,2 và y=0,1
mZn=65.0,2=13gam; mFe=56.0,1=5,6gam
-Tính nồng độ mol HCl theo trường hợp 500ml HCl vì HCl phản ứng hết.
Cứ 1 mol hỗn hợp kim loại tạo 1 mol hỗn hợp muối thì tăng 71 gam
Vậy x mol hỗn hợp kim loại tạo x mol hỗn hợp muối thì tăng 34,575-18,6=15,975 gam
\(\rightarrow x=\dfrac{15,975}{71}=0,225mol\)
\(\rightarrow n_{HCl}=2x=0,45mol\rightarrow C_{M_{HCl}}=\dfrac{0,45}{0,5}=0,9M\)
Ngoài ra còn có thể tính cách khác nữa!bạn tự tham khảo nhé!

Thí nghiệm 1 :
\(m_{Cl} = m_{muối} - m_{kim\ loại} = 5,82-2,98 = 2,84(gam)\\ \Rightarrow n_{HCl} = n_{Cl} = \dfrac{2,84}{35,5} = 0,08(mol)\\ \Rightarrow C_{M_{HCl}} = \dfrac{0,08}{0,2} = 0,4M\)
Thí nghiệm 2 :
\(\left\{{}\begin{matrix}Fe:a\left(mol\right)\\Zn:b\left(mol\right)\end{matrix}\right.\)\(\Rightarrow\) 56a + 65b = 2,98(1)
\(\left\{{}\begin{matrix}FeCl_2:a\left(mol\right)\\ZnCl_2:b\left(mol\right)\end{matrix}\right.\)\(\Rightarrow\) 127a + 136b = 6,53(2)
(1)(2) suy ra: a = 0,03 ; b = 0,02
Vậy :
\(\%m_{Fe} = \dfrac{0,03.56}{2,98}.100\% = 56,38\%\\ \%m_{Zn} = 100\% -56,38\% = 43,62\%\)

mình làm thế này, bn xem thử nhé:
A:V1 NaOH 1M
B:V2 H2SO4 0.5M
Từ TN1, ta thấy dd C td với Al2(SO4)3 thu dc kết tủa--> có NaOH trong dd C--> NaOH còn dư sau phản ứng--> H2SO4 tác dụng hết
--> Tính theo số mol H2SO4
nH2SO4=CM.V2=0.5V2(mol)
2NaOH+H2SO4-->Na2SO4+2H2O
V2<------0.5V2-------->0.5V2----V2 (mol)
TN1: nAl2O3=0.06(mol)
6NaOH+Al2(SO4)3--->2Al(OH)3+3Na2SO4
0.36<-----0.06<-------------0.12 (mol)
2Al(OH)3--->Al2O3+3H2O
0.12<-----------0.06 (mol)
==> nNaOH dư =0.36 (mol)
==> dd C gồm 2 chất:Na2SO4:0.5V2(mol) và NaOH dư=0.36(mol)
TN2:nBaSO4=0.15(mol)
Na2SO4+BaCl2-->BaSO4+2NaCl
0.15<---------------------0.15 (mol)
==> có: 0.15=0.5V2==>V2=0.3(L)
nNaOH ban đầu= V2+nNaOH dư=0.3+0.36=0.66(mol)
==>V1=n/CM=0.66/1=0.66(M)
Cảm ơn vì câu trả lời của bạn!Nhưng bạn có thể cho mình hỏi nếu giải theo kiểu cua bạn thì 6,12gam chất rắn để làm gì

Do tính khử Zn > Fe nên Zn phản ứng trước.
Do khối lượng rắn khan ở thí nghiệm 2 > thí nghiệm 1.
Do đó, ở thí nghiệm 1 HCl hết, kim loại có thể dư. Ở thí nghiệm 2, kim loại hết, HCl có thể dư.
\(Zn + 2HCl \to ZnCl_2 + H_2\\ Fe + 2HCl \to FeCl_2 + H_2\\ n_{Zn} = a ; n_{Fe} = b\\ m_A = 65a + 56b = 18,6\\ m_{chất\ rắn} = 136a + 127b = 39,9\\ \Rightarrow a = 0,2; b = 0,1\\ \Rightarrow m_{Zn} = 0,2.65 = 13(gam) ; m_{Fe} = 0,1.56 = 5,6(gam)\)
Thí nghiệm 1 :
\(n_{Fe\ pư} = x(mol) ; n_{Fe\ dư} = y(mol)\\ \Rightarrow x + y = 0,1(1)\\ n_{FeCl_2} = x (mol)\\ \Rightarrow m_{chất\ rắn} = 0,2.136 + 127x + 56y = 34,575(2)\\ (1)(2)\Rightarrow x = 0,025 ; y = 0,075\\ n_{HCl} = 2n_{Zn} + 2n_{Fe\ pư} = 0,2.2 + 0,025.2 = 0,45(mol)\\ C_{M_{HCl}} = \dfrac{0,45}{0,5} = 0,9M\)




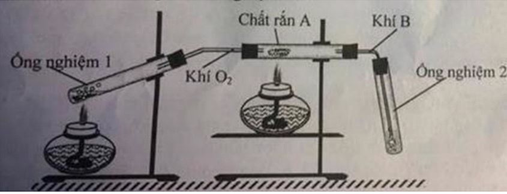
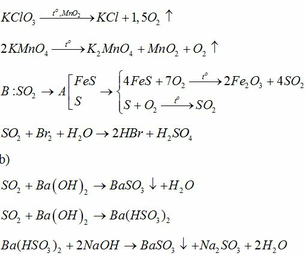
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
nAgNO3 = V1. 0,5 (mol)
=> nAg = 0,5.V1 mol và nFe dư = \(\dfrac{0,5.V_1}{2}\)(mol)
=> Khối lượng chất rắn thu được = mAg + mFe dư
= 108.0,5.V1 + m- \(\dfrac{56.0,5V_1}{2}\)= m+ 40V1 (gam)
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
nCu(NO3)2 = 0,2.V2 (mol)
Giả sử Fe dư , Cu(NO3)2 hết => nCu = nCu(NO3)2 =nFe phản ứng = 0,2.V2 (mol)
Khối lượng chất rắn sau phản ứng = mCu + mFe dư(mFe ban đầu - mFe phản ứng)
= 64.0,2.V2 + m - 56.0,2.V2 = 1,6V2 + m (gam)
Khối lượng chất rắn thu được ở 2 TN là như nhau
=> 1,6V2 + m = m + 40V1
<=> 1,6V2 = 40V1
<=> \(\dfrac{V_1}{V_2}\)= \(\dfrac{1,6}{40}\)=\(\dfrac{1}{25}\)