Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

B đúng.
nHBr = 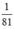 mol
mol
nNaOH = 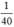 mol
mol
NaOH + HBr → NaBr + H2O
nNaOH > nHBr (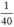 >
> 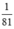 ) ⇒ sau phản ứng NaOH dư
) ⇒ sau phản ứng NaOH dư
⇒ nhúng giấy quỳ vào dung dịch thu được giấy quỳ sẽ chuyển màu xanh

Chọn đáp án A
(1) Trong nhóm halogen, tính phi kim và độ âm điện giảm dần từ flo đến iot.
Đúng.Theo SGK lớp 10.
(2) Các halogen đều có các trạng thái oxi hóa -1, 0, +1, +3,+5, +7.
Sai.Flo chỉ có -1 và 0
(3) Các halogen đều có tính oxi hóa mạnh, chúng phản ứng được với hầu hết kim loại, với hiđro và nhiều hợp chất.
Đúng.Theo SGK lớp 10
(4) Trong dãy axit không chứa oxi của halogen từ HF đến HI tính axit và tính khử tăng dần.
Sai.Tính khử và tính axit giảm dần
(5) Cho các dung dịch muối NaX (X là halogen) tác dụng với dung dịch AgNO3 đều thu được kết tủa AgX.
Sai.AgF là chất tan

Câu 1 :
\(n_{HCl}=\dfrac{7,3}{36,5}=0,2\left(mol\right)\)
\(n_{CaCO3}=\dfrac{15}{100}=0,15\left(mol\right)\)
Pt : \(CaCO_3+2HCl\rightarrow CaCl_2+CO_2+H_2O|\)
1 2 1 1 1
0,15 0,2 0,1
Lập tỉ số so sánh : \(\dfrac{0,15}{1}>\dfrac{0,2}{2}\)
⇒ CaCO3 dư , Hcl phản ứng hết
⇒ Tính toán dựa vào số mol của Hcl
\(n_{CO2}=\dfrac{0,2.1}{2}=0,1\left(mol\right)\)
\(V_{CO2\left(dktc\right)}=0,1.22,4=2,24\left(l\right)\)
Chúc bạn học tốt

Câu 1: Halogen nào ở thể rắn trong điều kiện thường?
b.Iot
Câu 2: Halogen nào có tính phi kim mạnh nhất?
c.Flo
Câu 3: Halogen nào có tính thăng hoa?
b.Iot
Câu 4: Cấu hình electron lớp ngoài cùng của nhóm halogen là:
c.ns2np5
Câu 5: Số cặp electron chưa liên kết xung quanh nguyên tử Clo trong ion ClO- là:
c.3
Câu 6: Phát biểu nào sau đây không đúng:
b. Tính axit tăng dần HI< HBr < HCl
Câu 7: Những phân tử nào sau đây không phân cực:
d. Br2 e. BrCl
Câu 8: Nước clo có tính khử trùng và tẩy màu do:
c. Chứa HClO là một chất oxi hoá mạnh.
Câu 9: Chọn dãy axit theo chiều tăng dần tính axit
d. HF HCl HBr HI
Câu 10: Cho các axit sau : HClO3 , HIO3 , HBrO3 . Sắp xếp chiều tính axit mạnh dần
c. HClO3 HBrO3 HIO3
Câu11: Hiđroclorua tan nhiều trong nước vì:
b. Hiđroclorua là một phân tử phân cực.
Câu12: Thành phần của nước clo gồm:
d. Cl2 , HCl , HClO , H2O
Câu13:Trong các phản ứng có acid HCl tham gia thì HCl có thể đóng vai trò là:
a. Chất khử c. Chất trao đổi
b. Chất oxi hoá d. Tất cả đều đúng
Câu14: Số oxi hoá của clo trong clorua vôi ( CaOCl2) là:
a. 0 b. -1 c. +1 d. bvà c
Câu15: Tính chất hoá học của axit clohiđric là:
a. Tính axit b. Tính khử c. Tính oxi hoá
d. a,b,c đều đúng . e. a , b đều đúng
Câu16: Trong công nghiệp, HCl có thể được điều chế từ :
a. Muối natriclorua khan và axit sunfuric đặc có đun nóng
b. Cl2 và H2
c. a,b đều đúng
d. Phương pháp khác
Câu17: Thuốc thử đặc trưng để nhận biết gốc clorua là:
a. AgNO3 b. Quỳ tím c. Ba(NO3)2 d. a,b,c đều đúng.
Câu18: Cặp chất nào sau đây không tồn tại trong một dung dịch:
1) MgCl2 & AgNO3............... 3) HCl & Ba(OH)2
2) ZnBr2 & Pb(NO3)3................ 4) HCl & KI
a. 1, 2, 3, 4 b.1, 2, 3 c. 1,2 d. 4,2
Câu19: Tính oxi hoá mạnh của flo thể hiện qua phản ứng:
a. Khí flo oxi hoá nước dễ dàng ở nhiệt độ thường.
b. Khí flo oxi hoá hầu hết kim loại và phi kim.
c. Khí flo phản ứng với khí hiđrô ở nhiệt độ rất thấp và ngay trong bóng tối.
d. Tất cả đều đúng.
Câu20: Dung dịch nào trong các dung dịch axit sau đây không được chứa trong bình bằng thuỷ tinh:
a. HCl b. H2SO4 c. HNO3 d. HF
Câu21: Nguyên tắc điều chế flo là:
a. Cho các chất có chứa ion Ftác dụng với các chất oxi hoá mạnh.
b. Điện phân hỗn hợp KF và HF
c. Cho HF tác dụng với chất oxi hoá mạnh.
d. Dùng chất có chứa flo để nhiệt phân ra flo
câu 5 Số cặp electron chưa liên kết xung quanh nguyên tử Clo trong ion ClO- sao lại là.3 v bạn

Đây là ý kiến của mình
1B,2B,3A, 4A, 5B, 6A, 7A, 8C, 9C, 10B, 11B, 12D, 13B, 14A, 15B, 16B, 17C