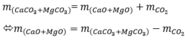Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 2:
PTHH: 2H2 + O2 -to->2H2O
Ta có: \(n_{H_2}=2\left(mol\right)\\ n_{O_2}=1\left(mol\right)\)
Theo PTHH và đề bài, ta có:
\(\dfrac{2}{2}=\dfrac{1}{1}\)
=> Không có chất nào dư.

a) PTHH : \(X_2O_3+3CO \rightarrow 2X+3CO_2\)
\(n_{CO_2}=0,15 (mol)\)\(\rightarrow n_{O(oxit)}=0,15 (mol)\)
\(m=m_{hh}-m_{O}=10,8-0,15.16=8,4 (g)\)
b) Gọi a là số mol của X và \(X_2O_3\)
\(aX+a(2X+16.3)=10,8\) \(\rightarrow 3aX+48a=10,8\) (*)
\(n_{X_2O_3}=0,05 (mol) \rightarrow a=0,05 (mol)\)
Thay \(a=0,05 (mol)\) vào (*) ta được : \(0,15X+48.0,05=10,8 \rightarrow X=56\) ( Vô lý )
Vậy X là Fe và \(X_2O_3\) là \(Fe_2O_3\)

Câu 2:
Dung dịch NaCl bão hoà ở 25°C là dung dịch chứa 36 g NaCl trong 100 g H2O.
Như vậy, 75 g nước ở 25°C sẽ hoà tan được :
\(m_{NaCl}=\frac{36.75}{100}=27\left(g\right)\)
Dung dịch NaCl đã pha chế là chưa bão hoà, vì dung dịch này có thể hoà tan thêm được : 27 – 26,5 = 0,5 (g) NaCl ở nhiệt độ 25°C.
Câu 1. PTHH:
1. \(2CO+O_2\rightarrow2CO_2\uparrow\)
2. \(2H_2+O_2\rightarrow2H_2O\)
Số mol của oxi: \(\frac{89,6}{22,4}=4\left(mol\right)\)
- Từ PTHH trên ta nhận thấy:
+ 2 mol H2 ( hay CO) đều phản ứng với 1 mol oxi.
+ 8 mol hỗn hợp phản ứng với 4 mol oxi.
- Gọi số mol CO là x, số mol H2 là \(\left(8-x\right)\)
\(28x+2\left(8-x\right)=68\)
Giải ra ta có: \(x=2\)
\(\%V_{CO}=\frac{2}{8}\cdot100\%=25\%\)
\(\%V_{H_2}=\frac{6}{8}\cdot100\%=75\%\)

2.
Số mol CuO là: \(n_{CuO}=\frac{m}{M}=\frac{40}{80}=0,5\left(mol\right)\)
\(PTHH:CuO+CO\rightarrow Cu+CO_2\uparrow\)
\(\left(mol\right)\) \(1\) \(1\) \(1\) \(1\)
\(\left(mol\right)\) \(0,5\) \(0,5\) \(0,5\) \(0,5\)
Ta có: \(H=\frac{n_{TT}}{n_{LT}}\Leftrightarrow n_{TT}=n_{LT}.H=0,5.90\%=0,45\left(mol\right)\)
Khối lượng Cu thu được là:
\(m_{Cu}=n.M=0,45.64=28,8\left(g\right)\)

Theo gt: \(n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
\(Fe_3O_4+4H_2\underrightarrow{t^o}3Fe+4H_2O\) (1)
\(PbO+H_2\underrightarrow{t^o}Pb+H_2O\) (2)
(1)(2) => \(n_{H_2}=n_{H_2O}=0,45\left(mol\right)\)
Áp dụng ĐLBTKL tính được m = 57,1 (g)

Câu 1 :
Zn + 2HCl \(\rightarrow\) ZnCl2 + H2 (1)
Fe + 2HCl \(\rightarrow\) FeCl2 + H2 (2)
a) Giả sử hỗn hợp chỉ có Fe
=> nFe = m/M = 37,2/56 = 93/140 (mol)
Theo PT(2) => nHCl(tối đa cần dùng) = 2 . nFe = 2 x 93/140 =1,329(mol)
mà nHCl(ĐB) =2(mol)
=> sau phản ứng : hỗn hợp kim loại tan hết và axit dư
b) Giả sử hỗn hợp X chỉ có Zn
=> nZn = m/M = 74,4/65 = 372/325 (mol)
Theo PT(1) => nHCl(tối thiểu cần dùng) = 2. nZn = 2 x 372/325 =2,289(mol)
mà nHCl(ĐB) =2 (mol)
=> Sau phản ứng hỗn hợp X không tan hết
Câu 2 :
Mg + HCl \(\rightarrow\) MgCl2 + H2 (1)
Zn + 2HCl \(\rightarrow\) ZnCl2 + H2 (2)
Fe + 2HCl \(\rightarrow\) FeCl2 + H2 (3)
Vì nMg : nZn : nFe = 1 : 2 : 3
=> nMg = a (mol) nZn = 2a(mol) và nFe =3a(mol)
=> mMg = 24a (g) , mZn =130a(g) và mFe =168a(g)
=> mhỗn hợp = 24a + 130a + 168a =322a(g)
từ PT(1) (2) (3) => tổng nH2 = nMg + nZn + nFe =6a (mol)
Sau phản ứng thấy khối lượng dung dịch tăng lên đúng bằng m(khối lượng của hỗn hợp Y) - mH2(thoát ra) = m - 2,4 hay :
mH2 = 2,4(g) => 6a x 2 = 2,4 => a =0,2(mol)
=> m = 322a = 322 x 0,2 =64,4(g)

Câu 1 :
gọi số mol Mg phản ứng là a, mol Cu phản ứng là b
n H2 = 5,6/22,4 = 0,25 mol
PT
Mg + 2HCl -> MgCl2 + H2
a_____2a______a_____a__ (mol)
Cu + 2HCl -> CuCl2 + H2
b____2b_____b______b__ (mol)
n H2 = a+b = 0,25 (I)
mhỗn hợp kl = 24a + 64b = 10 (II)
giải Hệ PT I,II ta được
a = 0.15
b = 0.1
-> nHCl phản ứng = 2*0,15 + 2* 0,1 = 0,5 mol
-> mHCl phản ứng = 0,5 * 36,5 = 18,25 g
-> C% HCl (dd phản ứng) = 18,25/120 *100% = 15,21%
m dung dịch sau phản ứng = 120 +10 = 130g
C% Cu (dd sau) = 64*0,1 /130 *100% = 4,92%
C% Mg (dd sau) = 24*0,15 / 130 *100% = 2,77%
c, n CuO = 32/ 80 = 0,4 mol
PT CuO + H2 - > Cu + H2O
nx: 0,4/1 > 0,25/1 -> H2 hết, CuO dư, sản phẩm tính theo H2
theo PT nCu = nH2 = 0,25 mol
-> mCu = 0,25 * 64 = 16g