Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, \(n_{CuO}=\dfrac{4}{80}=0,05\left(mol\right)\)
PT: \(Cu\left(OH\right)_2\underrightarrow{t^o}CuO+H_2O\)
Theo PT: \(n_{Cu\left(OH\right)_2}=n_{CuO}=0,05\left(mol\right)\)
\(\Rightarrow m_{Cu\left(OH\right)_2}=0,05.98=4,9\left(g\right)\)
b, \(m_{H_2SO_4}=250.9,8\%=24,5\left(g\right)\Rightarrow n_{H_2SO_4}=\dfrac{24,5}{98}=0,25\left(mol\right)\)
PT: \(Cu\left(OH\right)_2+H_2SO_4\rightarrow CuSO_4+2H_2O\)
Xét tỉ lệ: \(\dfrac{0,05}{1}< \dfrac{0,25}{1}\), ta được H2SO4 dư.
Theo PT: \(n_{CuSO_4}=n_{H_2SO_4\left(pư\right)}=n_{Cu\left(OH\right)_2}=0,05\left(mol\right)\)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=0,25-0,05=0,2\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{CuSO_4}=\dfrac{0,05.160}{4,9+250}.100\%\approx3,14\%\\C\%_{H_2SO_4\left(dư\right)}=\dfrac{0,2.98}{4,9+250}.100\%\approx7,69\%\end{matrix}\right.\)

a)
Cu(OH)2 ➝ CuO + H2O (2)
CuO + H2SO4➝ CuSO4 + H2O (1)
Đổi : 100ml= 0,1lít
Số mol axit sunfuric cần dùng là:
n= CM . V = 0,1 . 2=0,2 mol
Từ (1) ➜ nH2SO4= nCuO= 0,2mol
Khối lượng CuO đã nhiệt phân là:
m= n.M= 0,2. 80=16 (g)
Từ (2)➜nCu(OH)2= nCuO=0,2 mol
Khối lượng đồng hiđroxit đã dùng là:
m= n.M = 0,2.98=19,6 (g)
b)
Từ (1)➙ nCuSO4=nCuO= 0.2mol
Khối lượng muối thu được là:
m=n.M= 0,2 . 160=32 (g)
O

Cho m gam kim loại Mg vào dung dịch axit clohidric dư, phản ứng hoàn toàn tạo ra 6,72 lít khí hiđro (đktc). Giá trị của m là (biết Mg=24) *
7,2
3,6.
14,4.
6,72.
Nhiệt phân hoàn toàn 9,8 g Cu(OH)₂ thu được một chất rắn màu đen, dùng khí H₂ dư khử chất rắn màu đen đó thu được một chất rắn màu đỏ có khối lượng là (biết Cu=64, O=16, H=1) *
6,4 g
8 g.
12,8 g.
9,8 g.
Chất nào sau đây là muối *
KOH.
HCl.
CuSO4
MgO.
Nhúng 1 thanh kim loại đồng vào 100 ml dung dịch AgNO₃ 0,4 M. Sau khi phản ứng hoàn toàn thu được m gam kim loại bám trên thanh đồng. Giá trị của m là (biết Ag=108, Cu=64, N=14, O=16) *
4,32
21,6.
25,6.
12,8.
Phản ứng nào dưới đây là phản ứng trao đổi trong dung dịch? *
2Na + 2H₂O --> 2NaOH + H₂.
BaO + H₂O --> Ba(OH)₂.
Zn + H₂SO₄ --> ZnSO₄ +H₂.
BaCl2 + H2SO4 ---> BaSO4 + 2HCl
Cho 100ml dung dịch KOH 2M tác dụng với 200ml dung dịch H₂SO₄ 3M, sau phản ứng cho thêm một mảnh Mg dư vào sản phẩm thấy thoát ra một thể tích khí H₂ (đktc) là *
11,2 lít.
8,96 lít.
3,36 lít
6,72 lít
Hình như sai đề
Câu cuối đáp án là 11,2 lít nhé!
Câu kim loại đồng tính như nào ra 4,32 nhỉ?

2Fe(OH)3 -----to---> Fe2O3 + 3H2O
Mg(OH)2 ----to---> MgO + H2O
Gọi x, y lần lượt là số mol Fe(OH)3 và Mg(OH)2
\(\left\{{}\begin{matrix}107x+58y=16,5\\\dfrac{1}{2}.160x+y.40=12\end{matrix}\right.\)
=> x=0,1 ; y=0,1
\(\%m_{Fe\left(OH\right)_3}=\dfrac{107.0,1}{16,5}.100=64,85\%\)
%Mg(OH)2 = 35,15%
b) \(2Fe\left(OH\right)_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+6H_2O\)
0,1----------------------------------->0,05
\(Mg\left(OH\right)_2+H_2SO_4\rightarrow MgSO_4+2H_2O\)
0,1------------------------------------>0,1
\(m_{ddsaupu}=16,5+200=216,5\left(g\right)\)
\(C\%_{Fe_2\left(SO_4\right)_3}=\dfrac{0,05.400}{216,5}.100=9,24\%\)
\(C\%_{MgSO_4}=\dfrac{0,1.12}{216,5}.100=5,54\%\)

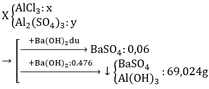
Cho Ba(OH)2 vào muối Al sẽ có 2TH sau:
TH1: kết tủa Al(OH)3 chưa bị hòa tan
Al3+ + 3OH– → Al(OH)3↓
→ nAl(OH)3 = nAl3+ → nAl(OH)3 = xn + 0,04n
TH2: kết tủa Al(OH)3 bị hòa tan một phần
Al3+ + 3OH– → Al(OH)3↓
(xn + 0,04n)→ 3(xn + 0,04n) (xn + 0,04n)
Al(OH)3 + OH– → AlO2– + 2H2O
0,952 – 3(xn + 0,04n) ←0,952
→ nAl(OH)3 = 4xn + 0,16n – 0,952


a) PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
Ta có: \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)=n_{Fe}=n_{FeCl_2}\) \(\Rightarrow\left\{{}\begin{matrix}C\%_{FeCl_2}=\dfrac{0,15\cdot127}{300}\cdot100\%=6,35\%\\m_{Fe}=0,15\cdot56=8,4\left(g\right)\end{matrix}\right.\)
b) PTHH: \(Cu+2H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}CuSO_4+SO_2\uparrow+2H_2O\)
Ta có: \(n_{Cu}=\dfrac{13,2-8,4}{64}=0,075\left(mol\right)=n_{SO_2}\) \(\Rightarrow V_{SO_2}=0,075\cdot22,4=1,68\left(l\right)\)


a) PTHH: \(Cu\left(OH\right)_2\xrightarrow[]{t^o}CuO+H_2O\)
Ta có: \(n_{CuO}=\dfrac{4}{80}=0,05\left(mol\right)=n_{Cu\left(OH\right)_2}\) \(\Rightarrow m_{Cu\left(OH\right)_2}=0,05\cdot98=4,9\left(g\right)\)
b) PTHH: \(Cu\left(OH\right)_2+H_2SO_4\rightarrow CuSO_4+2H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{Cu\left(OH\right)_2}=0,05\left(mol\right)\\n_{H_2SO_4}=\dfrac{250\cdot9,8\%}{98}=0,25\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Axit còn dư
\(\Rightarrow\left\{{}\begin{matrix}n_{CuSO_4}=0,05\left(mol\right)\\n_{H_2SO_4\left(dư\right)}=0,2\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}C\%_{CuSO_4}=\dfrac{0,05\cdot160}{4,9+250}\cdot100\%\approx3,14\%\\C\%_{H_2SO_4\left(dư\right)}=\dfrac{0,2\cdot98}{4,9+250}\cdot100\%\approx7,7\%\end{matrix}\right.\)