Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) \(n_{CuSO_4}=\dfrac{100.3,2\%}{160}=0,02\left(mol\right)\)
PTHH: CuSO4 + Fe ---> FeSO4 + Cu
0,02---->0,02--->0,02----->0,02
=> mFe (pư) = 0,02.56 = 1,12 (g)
b) mdd sau pư = 100 + 1,12 - 0,02.64 = 99,84 (g)
=> \(C\%_{FeSO_4}=\dfrac{0,02.152}{99,84}.100\%=3,045\%\)

\(n_{NaOH}=\dfrac{100.8%}{100\%.40}=0,2(mol)\\ n_{FeCl_2}=\dfrac{254.10\%}{100\%.127}=0,2(mol)\\ PTHH:2NaOH+FeCl_2\to Fe(OH)_2\downarrow +2NaCl\)
Vì \(\dfrac{n_{NaOH}}{2}<\dfrac{n_{FeCl_2}}{1}\) nên \(FeCl_2\) dư
\(\Rightarrow n_{Fe(OH)_2}=\dfrac{1}{2}n_{NaOH}=0,1(mol);n_{NaCl}=0,2(mol)\\ \Rightarrow m_{Fe(OH)_2}=0,1.90=9(g);m_{NaCl}=0,2.58,5=11,7(g)\\ b,C\%_{NaCl}=\dfrac{11,7}{100+254-9}.100\%=3,39\%\)

a) \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
nFe = nH2 = 0,3 (mol)
\(\Rightarrow m_{Fe}=0,3.56=16,8\left(g\right)\)
b) nHCl = 2.nH2 = 0,6 (mol)
\(\Rightarrow V_{ddHCl}=\dfrac{0,6}{0,3}=2\left(l\right)\)
c) \(n_{FeCl_2}=n_{H_2}=0,3\left(mol\right)\)
\(\Rightarrow C_{M\left(FeCl_2\right)}=\dfrac{0,3}{2}=0,15M\)

\(n_{CuSO_4}=\dfrac{200.8}{100.160}=0,1(mol)\\ PTHH:Fe+CuSO_4\to FeSO_4+Cu\\ a,n_{Cu}=n_{Fe}=n_{CuSO_4}=0,1(mol)\\ \Rightarrow m_{Cu}=0,1.64=6,4(g);m_{Fe}=0,1.56=5,6(g)\\ b,n_{FeSO_4}=0,1(mol)\\ \Rightarrow C\%_{FeSO_4}=\dfrac{0,1.152}{5,6+200-6,4}.100\%=7,63\%\)

a./ Khối lượng AgNO3 trong dd ban đầu: m(AgNO3) = 250.6% = 15g
Khối lượng AgNO3 pư: m(AgNO3 pư) = 17%.15 = 2,55g
→ n(AgNO3) = 2,55/170 = 0,015mol
2AgNO3 + Cu → 2Ag + Cu(NO3)2
0,015___0,0075_0,015__0,0075
Khối lượng của vật lấy ra sau pư:
m = 50 + m(Ag) - m(Cu pư) = 50 + 0,015.108 - 0,0075.64 = 51,14g
b./ Khối lượng các chất có trong dd sau pư:
m[Cu(NO3)2] = 0,0075.188 = 1,41g
m(AgNo3 dư) = m(AgNO3) - m(AgNO3 pư) = 15 - 2,55 = 12,45g
Khối lượng dd thu được:
m(dd) = m(dd AgNO3) + m(Cu pư) - m(Ag) = 250 + 0,0075.64 - 0,015.108 = 248,86g
Thành phần % các chất có trong dung dịch
%AgNO3 dư = 12,45/248,86 .100% = 5%
%Cu(NO3)2 = 1,41/248,86 .100% = 0,57%

\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH :
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
0,25 0,5 0,25
\(a,m_{Fe}=0,25.56=14\left(g\right)\)
\(b,C_{M\left(HCl\right)}=\dfrac{0,5}{0,2}=2,5\left(M\right)\)

Ta có: \(m_{CuSO_4}=40.10\%=4\left(g\right)\Rightarrow n_{CuSO_4}=\dfrac{4}{160}=0,025\left(mol\right)\)
PT: \(Zn+CuSO_4\rightarrow ZnSO_4+Cu\)
Theo PT: \(n_{Zn}=n_{ZnSO_4}=n_{Cu}=n_{CuSO_4}=0,025\left(mol\right)\)
\(\Rightarrow m_{Zn}=0,025.65=1,625\left(g\right)\)
Ta có: m dd sau pư = 1,625 + 40 - 0,025.64 = 40,025 (g)
\(\Rightarrow C\%_{ZnSO_4}=\dfrac{0,025.161}{40,025}.100\%\approx10,056\%\)

\(2M+3Cl_2\Rightarrow 2MCl_3\\ \Rightarrow n_M=n_{MCl_3}\\ \Rightarrow \dfrac{10,8}{M_M}=\dfrac{53,4}{M_M+35,5.3}\\ \Rightarrow M_M=27\Rightarrow Al\)
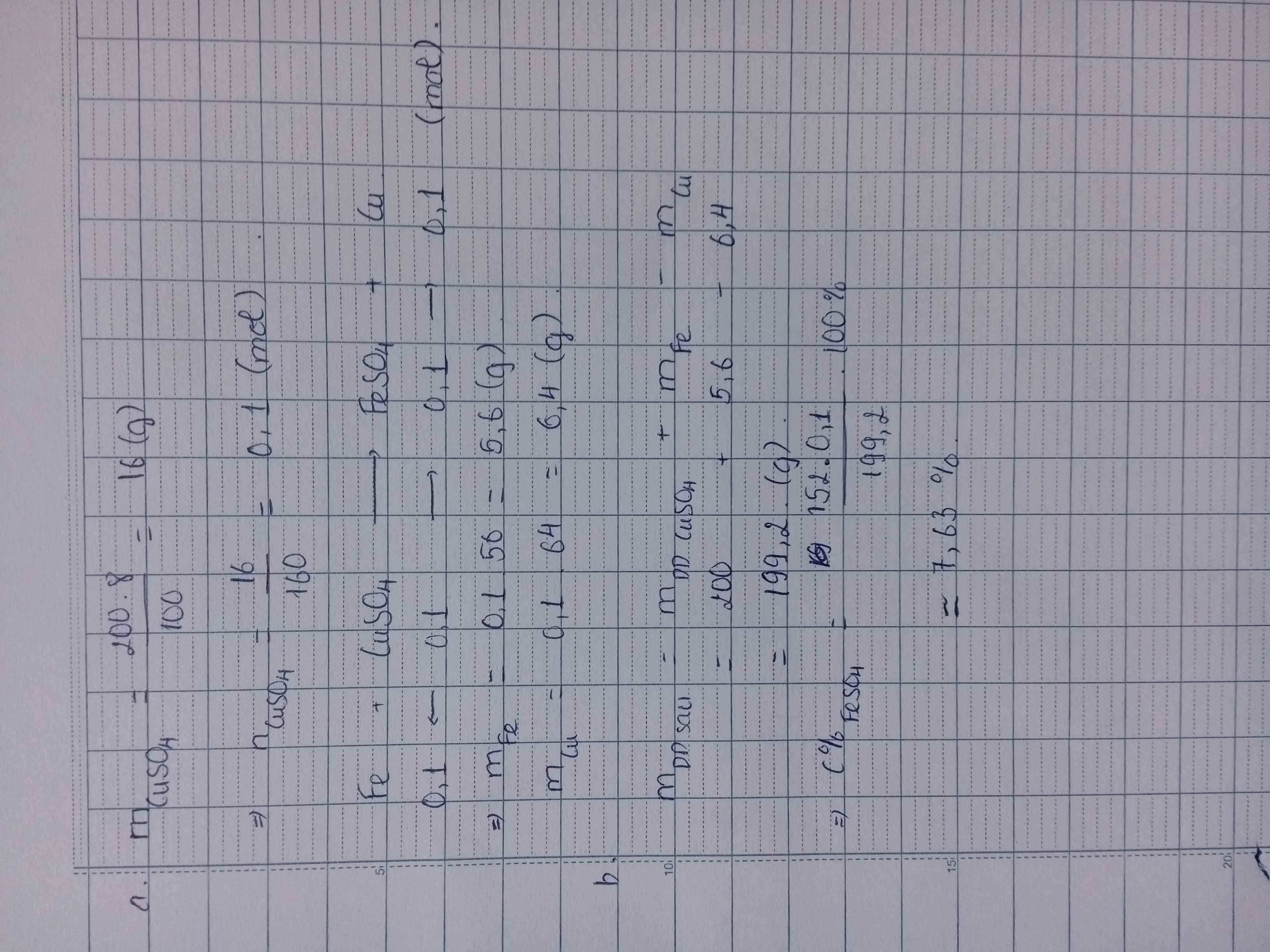
a) \(n_{AgNO_3}=\dfrac{170.10\%}{170}=0,1\left(mol\right)\)
PTHH: Cu + 2AgNO3 ---> Cu(NO3)2 + 2Ag
0,05<--0,1--------->0,05--------->0,1
=> mCu (pư) = 0,05.64 = 3,2 (g)
b) mdd sau pư = 170 + 3,2 - 0,1.108 = 162,4 (g)
=> \(C\%_{Cu\left(NO_3\right)_2}=\dfrac{0,05.188}{162,4}.100\%=5,79\%\)
\(a,Cu+2AgNO_3\rightarrow Cu\left(NO_3\right)_2+2Ag\\ n_{AgNO_3}=\dfrac{170.10\%}{170}=0,1\left(mol\right)=n_{Ag}\\ n_{Cu}=n_{Cu\left(NO_3\right)_2}=n_{AgNO_3}:2=0,1:2=0,05\left(mol\right)\\ m_{Cu}=0,05.64=3,2\left(g\right)\\ b,m_{ddsau}=m_{Cu}+m_{ddAgNO_3}-m_{Ag}=3,2+170-0,1.108=162,4\left(g\right)\\ C\%_{ddCu\left(NO_3\right)_2}=\dfrac{188.0,05}{162,4}.100\approx5,788\%\)